То, что транспозоны это не какая-то там «мусорная ДНК», запомнит любой, кто прочел предыдущую главу о том, на что они способны. Читая эту главу, стоит держать предыдущую открытой на списке транспозоновых функций: так будет удобнее представлять, что могут делать разные виды «прыгающих генов». Но прежде чем начинать разбираться, какие же бывают транспозоны — небольшое лирическое отступление о том, как люди склонны эти и похожие на них штуки воспринимать.
Интересно, что людям свойственно пытаться очеловечивать то, что на людей совсем не похоже. Например, сложно представить что-то более непохожее на тебя, чем бактерия. Но люди приписывают им какие-то намерения и желания, считая, что какие-то бактерии «злые», а какие-то «нам помогают». Что крокодил злой, раз он съел уточку. Что раковые клетки эгоистичные, плохие. А съедающий возбудителя болезни и погибающий после этого фагоцит герой-альтруист. Это происходит потому, что мы в основном взаимодействуем с людьми, для нас привычны именно такие морально-окрашенные ситуации. В результате наш мозг автоматически дорисовывает эти привычные ситуации, когда находит какие-то их подобия во всяких клеточных процессах. Есть еще такая сложность в переключении на адекватное восприятие мира: весь наш язык «заточен» под описание межличностных отношений, действий и желаний осознающего себя существа. И очень сложно описывать происходящие в клетках процессы, не очеловечивая их просто за счет привычного подбора слов.
Но гораздо интереснее и приятнее отдавать себе отчет в том, что в мире всяких инфузорий все немного иначе. Одни и те же бактерии могут приносить нам пользу или вред в зависимости от того, в каком месте нашего тела они находятся, сколько их и какими свойствами они обладают. Сидит у меня в кишечнике Escherichia coli (или кишечная палочка), и перерабатывает лактозу — молочный сахар. Сама я эту лактозу переработать не могу, и ее попадание в меня должно было бы вызывать самые разные неприятные симптомы. Но симптомов нет, сколько бы молока я ни выпила: потому что лактозу поедает мой симбионт E.coli. А если эта же бактерия попадет на поверхность глаза и размножится там, то у меня будут серьезные проблемы. А если она подцепит от какой-нибудь проплывающей мимо бактерии ген, позволяющий ей причинять мне вред с пользой для себя, то она именно этим и займется. Она не «плохая» и не «хорошая» — просто бактерия, которая пытается выживать, используя разные особенности окружающей среды. Наши многочисленные бактериальные симбионты заинтересованы в том, чтобы их окружающая среда (то есть наше тело) оставалась здоровой и поставляла им место для жизни и питательные вещества. Поэтому у нас с ними и получаются взаимовыгодные отношения, а не потому, что они хотят нам помогать.
То же относится и к транспозонам. Вот человек узнает о том, что в его геноме находятся «прыгающие гены», жизненный цикл которых заключается в создании как можно большего количества своих копий и встраивания их в геном. Какая его первая реакция? Восприятие их врагами, паразитами (в негативном смысле этого слова). А узнав, что транспозоны могут быть полезны, прочитав про примеры этого, их начинают считать «хорошими». В общем, транспозоны не хорошие и не плохие: это что-то вроде компьютерного кода, имеющего задачу размножиться. И этот компьютерный код в ненужном месте приводит к негативным последствиям для генома, которые его содержит. А в нужном месте приводит к появлению полезных свойств. И это не клетка «адаптировала под себя» транспозоны, «научившись» управлять их активностью. А в процессе естественного отбора выживали те клетки, в которых исходный геном и транспозоны пришли к взаимовыгодному балансу. Который иногда нарушается, и тогда в организме хозяина развивается болезнь. Но чаще это сотрудничество приводит к преимуществам для тех клеток, в которых существуют транспозоны. Примеры последнего будут ниже.
Так как транспозоны открыли сравнительно недавно, в их классификации нет единообразия, и иногда сложно соотносить информацию из разных источников. Мне удобнее их разделять по самым заметным внешним признакам на три группы, в каждой из которых будет несколько похожих транспозонов. В этой главе будут самые общие описания, касающиеся групп в целом, а конкретика перенесется в факультативную главу: для фанатов типа меня, с наслаждением сравнивающих хвосты разных мобильных генетических элементов и докапывающихся до того, кто появился раньше: транспозоны или ретровирусы.
Первая большая группа транспозонов — ретроэлементы с LTR. «Ретро-» — потому что похожи на ретровирусы. Но на самом деле сходство с вирусами есть и у других транспозонов. Поэтому удобно выделять эту группу по признаку, отсутствующему у других: на обоих концах этих транспозонов есть длинные последовательности из повторяющихся групп нуклеотидов. Эти длинные концевые элементы называют LTR (long terminal repeats): сами по себе они никакой продукт не кодируют, и выполняют чисто служебную функцию при копировании транспозона. В общем, это что-то вроде теломер, которые защищают концы наших хромосом и про которые немного написано в конце предыдущей транспозоновой главы. В промежутках между двумя LTR находится смысловая часть ретроэлемента: гены, кодирующие необходимые для «прыжков» транспозона ферменты. Чаще всего эти гены заметно мутировавшие, утратившие свою функцию, что не мешает такому внешне неактивному ретроэлементу копироваться: ведь если другой, активный транспозон производит нужные ферменты, то ими могут пользоваться все остальные. Еще в этот транспозон могут встроиться не транспозоновые, а принадлежащие другим частям ДНК клетки гены. Получится что-то типа матрешки или пельменя: с концов — транспозон, а в середине кое-что другое. Если такой фаршированный транспозон будет копироваться и встраиваться в новые места генома, то он перенесет с собой и вставленный ген (про это подробнее — в предыдущей главе).
Размножаются ретроэлементы с LTR репликативно: то есть сами они никуда не прыгают, а вместо этого создают свои копии. Новые транспозоны встраиваются в клеточную ДНК — иногда рядом с тем местом, где был исходный ретроэлемент, а иногда они очень далеко переносятся, даже на соседние хромосомы.
В нашем геноме ретроэлементов с LTR сравнительно немного, 8,5%. А вот в геномах некоторых растений таких штук гораздо больше: например, они занимают половину генома кукурузы (и это только один вид транспозонов!). У человека большинство ретроэлементов деактивированы мутациями, но они все равно могут проявлять какую-то активность: например, даже если транспозон потерял возможность создавать свои копии и встраивать их в геном, по содержащимся в нем последовательностям нуклеотидов могут строиться какие-то протеины. Такие частично активные транспозоны называют эндогенными ретровирусами, самый известный из которых — HERV-W — критически важен для нашего существования. По нему строится протеин, способствующий слиянию клеток. Неудивительно, что мы заимствовали его именно от вируса: ведь один из путей проникновения классических вирусов в клетку это как раз слияние их собственной оболочки с клеточной мембраной. В отсутствие этого протеина зародыш любого млекопитающего погибает почти сразу же после зачатия, потому что у него не может сформироваться плацента: орган, соединяющий зародыш с материнским телом, через который будет поступать все жизненно необходимое для роста и развития.
Вторая большая группа транспозонов представлена элементами LINE и SINE. Из этой пары LINE (длинные рассеянные ядерные элементы, или Long Interspersed Nuclear Elements) более впечатляющие, в них даже гены есть. А SINE — это что-то вроде укороченной до предела версии LINE: короткие рассеянные ядерные элементы (Short Interspersed Nuclear Elements) не содержат генов, зато у них есть такой же хвост, как у LINE. Почему этот «почти-что-хвост» вообще заслуживает отдельного упоминания? Да потому, что целых 14% нашего генома составляют именно SINE. А LINE вообще чемпион в этом отношении: им занято более 20% нашей ДНК.
Эти штуки довольно сильно похожи на ретроэлементы с LTR: тоже размножаются репликативно, тоже в основном находятся в мутировавшем неактивном состоянии. Главное отличие в том, что у любого транспозона второй группы нет концевых повторов нуклеотидов (LTR), зато на одном из его концов есть так называемый поли-А хвост. То есть длинная последовательность из нуклеотидов аденинов. Функция у нее та же, что и у LTR: хвост используется при копировании транспозона.
Действия SINE в геноме не особенно впечатляющие, зато одна из функций LINE переворачивает все представления о «мусорных» транспозонах и их взаимодействии с человеком, поэтому мимо нее пройти оказалось невозможно.
Как ты думаешь, в каких клетках твоего тела мутации более всего нежелательны, где их действие может принести наибольший вред? Не удивлюсь, если в первую очередь тебе пришел в голову мозг. (Я не имела в виду, что его там не было! Он был, и вот просто еще раз пришел:) Так вот именно там наблюдается повышенная активность транспозона LINE, причем именно тогда, когда мозг в наибольшей степени подвержен любому влиянию: на самых ранних стадиях его развития.
Но давай по порядку. Началось все с того, что группе ученых под руководством Фреда Гейджа (Fred Gage) — нейробиолога, опровергшего популярный миф о том, что «нервные клетки не восстанавливаются» — пришло в голову заглянуть в развивающийся мозг и оценить, насколько там активны транспозоны. Ученым еще и не такое в голову приходит, и часто такие неожиданные эксперименты вознаграждаются еще более неожиданными открытиями. Был выбран самый распространенный и активный из человеческих транспозонов: LINE-1, или просто L1.
В каждой нашей клетке присутствует примерно шестьсот тысяч его копий, но лишь 80 — 100 из них являются полностью активными, то есть:
- способными к копированию и
- содержащими работающие гены.
Для активности транспозона необходимо первое условие и всего лишь желательно второе. Чтобы понять, почему так происходит, необходимо разобраться — как же он копируется и что за гены он в себе несет. По транспозоновым генам строятся именно те протеиновые ферменты, которые помогут ему скопироваться, что вполне ожидаемо. Изначально ведь транспозоны являются последовательностями, нацеленными исключительно на размножение в геноме. И если ты транспозон и очень хочешь размножиться, то не стоит рассчитывать на то, что где-то в клетке будет болтаться нужный тебе для размножения набор ферментов. Лучше иметь все чертежи при себе. Вот они и имеют — прежде всего ген, по которому строится обратная транскриптаза, знакомая тебе по предыдущей главе. Этот фермент по скопированной с транспозона молекуле РНК создает двухцепочечную молекулу ДНК, идентичную исходному транспозону. Остальные чертежи транспозона служат для построения тех ферментов, которые помогают скопированному транспозону встроиться в новое место ДНК.
Почему транспозон все-таки может быть активным даже при условии, что гены для построения таких необходимых ему ферментов повреждены? Потому, что в клетке полно других копий L1, и часть из них точно содержит неповрежденные гены, по которым построятся нужные штуки, ну а другие транспозоны ими воспользуются. Так что не стоит особенно цепляться за то, что в клетке менее ста полностью активных копий L1: другие его копии тоже могут найти, чем дублироваться.
Отследить активность прыгающих генов внутри живого, развивающегося мозга (или хотя бы его клеток, растущих и делящихся в чашке Петри) — креативная задача. Для ее решения ученые создали «в пробирке» особую копию L1, в середину которой встроили ген флюоресцирующего протеина. Чтобы отличать ее от обычных содержащихся в клетке копий L1, я буду называть эту особую копию ф-L1. Ты же помнишь про такую особенность транспозонов: если в них попал какой-то новый ген, то он будет копироваться и вставляться вместе с остальными частями этой прыгающей штуки. Значит, попав из пробирки в клетку, ф-L1 будет распространять встроенный в него ген по всему клеточному геному.
Этот «ген свечения» был встроен очень хитро: пока ф-L1 сидит в геноме молча и не копируется, всунутый ген не считывается. А если ф-L1 начнет создавать свои копии, то уже в них ген светящегося протеина активируется и клетка засветится загадочным зеленым светом. Так что если ф-L1 встроится в ДНК клетки и начнет там размножаться, то не заметить это будет невозможно. Осталось только достать его из пробирки и добавить в какую-нибудь клетку, чтобы посмотреть, что получится.
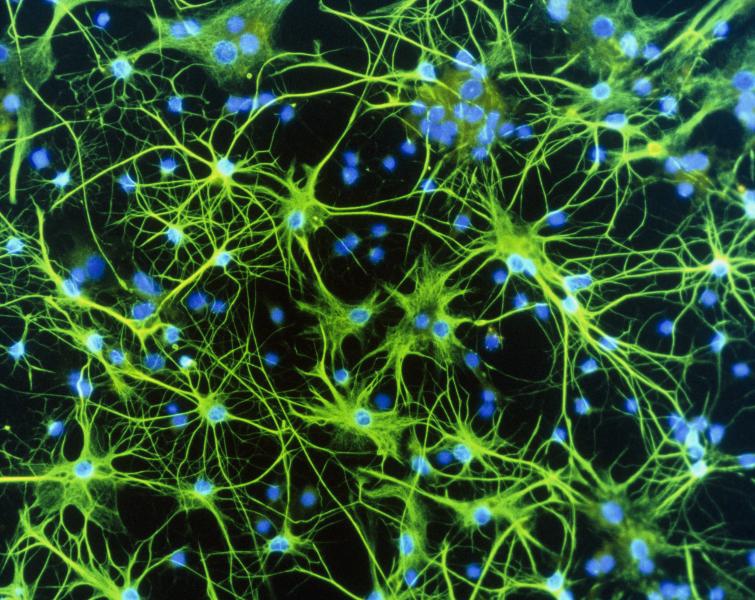
Для начала ф-L1 встроили в человеческие нейральные клетки-предшественницы ( neural progenitor cells, NPC ), извлеченные из мозга человеческих эмбрионов. Так называется разновидность стволовых клеток, из которых в дальнейшем образуются все три основных типа клеток нервной системы: нейроны, астроциты и олигодендроциты. С нейронами ты уже знакома по предыдущим главам, а другие два типа клеток относят к нейроглие: клеткам, которые выполняют в мозге огромное количество функций, начиная от доставки нейронам питательных веществ и заканчивая помощью в передаче нейронных сигналов.
Результаты встраивания ф-L1 на первый взгляд оказались не очень впечатляющими: из каждых ста тысяч NPS засветились зеленым от восьми до двенадцати клеток. Но.. вспомни, что кроме ф-L1 в каждой клетке есть около сотни активных и еще около 500 тысяч в разной степени поломанных и в разной степени способных к копированию L1-транспозонов. И ты поймешь, что отслеживая один-единственный ф-L1, мы увидели только ничтожную часть L1-активности клетки. Чтобы это доказать, достаточно внимательнее рассмотреть, как клетка управляет активностью транспозонов.
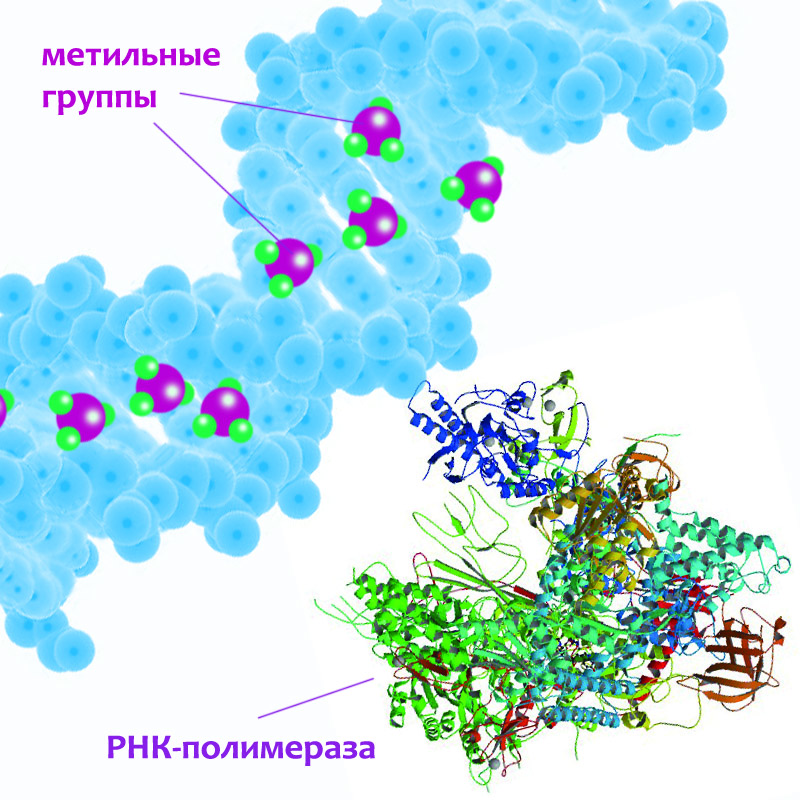
В обычном состоянии клетки транспозоны (неважно, способные прыгать или уже «поломанные» мутациями) надежно заблокированы с помощью обычного механизма выключения генов: на нуклеотиды транспозона навешиваются метильные группы (СН3), что мешает считывать такой метилированный участок ДНК. Кажется, что по сравнению с толщиной молекулы ДНК эти метильные группы очень маленькие и не могут играть существенную роль, но на самом деле это очень эффективный способ блокировки считывания. Чтобы что-то построить по гену, необходимо сначала создать его РНК-копию с помощью РНК-полимеразы. А она чисто механически не может прицепиться к такому ощетинившемуся метильными группами участку, так что РНК не строится и ген остается молчащим. Вот поэтому, несмотря на огромное количество активных транспозонов в клетках твоего тела, ты не мутируешь непрерывно — покрываясь перьями или зеленея:). Они просто метилированы и молчат.
Но именно в клетках-предшественниках нейронов, и именно в тот промежуток времени, когда они должны активно делиться, создавая почти с нуля человеческий мозг, эти «заглушки» в виде метильных групп с транспозонов L1 снимаются — полностью или частично. И больше ничто не мешает ему выполнять свое естественное предназначение: создавать копии и встраивать их в геном. Так что в засветившихся зеленым клетках ф-L1 прыгал именно потому, что каждая из клеток сняла «заглушки» с L1-транспозонов и у них появилась возможность копировать себя. Причем клетка не могла бы разблокировать только ф-L1 версию транспозона, оставив при этом в метилированном состоянии другие — активные и неактивные — последовательности L1 (которых, как ты помнишь, в клетке около 600 тысяч). Ведь чтобы разблокировать этот единственный «прыгающий ген», клетка создает клеточные машинки, которые убирают метильные группы именно с транспозонов L1. А эти машинки не ограничиваются активностью в одном-единственном месте. Они будут путешествовать по геному во всех направлениях и откусывать метильные группы у L1 везде, где найдут.
Итак, на этапе раннего развития нашего мозга, когда он только начинает формироваться и содержит клетки-предшественники нейронов, в нем создаются благоприятные условия для размножения транспозонов. По последним оценкам ученых, в некоторых участках мозга каждая клетка содержит от восьмидесяти до восьмиста (!) таких мутаций. Очень неожиданно и немного пугает (особенно если вернуться к предыдущей главе и перечитать часть «что может транспозон»), но стоить вспомнить: это АБСОЛЮТНО НОРМАЛЬНЫЙ процесс. С его помощью появился и твой мозг, и мозг Фейнмана, и ни у кого из вас голова не позеленела и рога не выросли.
Как обнаружили, что этот процесс затрагивает именно нейроны головного мозга, а не является обычным для всех клеток тела:
1. Ученые сравнили уровень метилирования L1 в клетках мозга человеческого эмбриона и в клетках его же кожи. Оказалось, что в коже уровень метилирования высокий (а значит, транспозоны надежно заблокированы и не копируются), а в мозге транспозоны метилированы слабо или вообще полностью открыты для считывания.
2. Копии L1, содержащие ген флюоресцирующего протеина, встроили в клетки нейроглии: те самые, которые тоже находятся в мозге и всячески содействуют живущим там нейронам. И там все осталось уныло-серым, никакого свечения.
3. Были взяты пробы ДНК из десяти разных отделов мозга у троих взрослых людей. И для чистоты эксперимента у тех же людей взяли пробы из печени и сердца. Во всех этих пробах посчитали количество копий L1 и стали сравнивать результаты по-всякому, пытаясь найти закономерности. Да, современные методы исследования позволяют посчитать, сколько копий определенной последовательности нуклеотидов содержится в ДНК клетки! Причем с огромной точностью: когда счет идет на сотни тысяч копий, можно установить, содержится ли там всего лишь 600 002 копии L1 или целых 600 005.
Так вот оказалось, что число копий L1 в геномах клеток мозга у всех троих больше, чем в геномах клеток сердца и печени — в среднем на 80 штук. Целых 80 генетических модификаций на каждый нейрон! Тут уже невозможно было игнорировать тот факт, что именно в мозге геном подвергается редактированию. Причем когда сравнивали количество копий L1 в одном и том же участке мозга разных людей, получались разные числа. Значит, у одного человека в то время, когда он только развивался, считалось и встроилось больше транспозонов, а у другого меньше. Почему так получилось? Есть только предположения. Во-первых, само по себе размножение транспозонов является вероятностным процессом: не может быть одинаковым количество копий этих штук, которые создались и успешно встроились. Во-вторых, есть экспериментальные подтверждения того, что на активность транспозонов влияют и факторы окружающей среды, и состояние организма, в котором они находятся. Эти условия у разных зародышей очень отличаются, что и может влиять на количество транспозонов в мозгу развившихся из них людей.
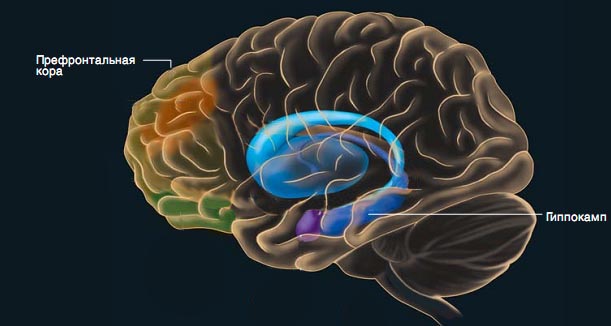
Интересно, что были различия и между количеством транспозонов в разных участках мозга одного и того же человека: больше всего копий L1 оказалось в нейронах гиппокампа и префронтальной коры. Не буду вдаваться в подробности строения мозга (глава и так получается довольно сложной), но вряд ли случайно так вышло, что наибольшим генетическим модификациям подвергаются именно отвечающий за память гиппокамп и префронтальная кора, которая отвечает за осознание себя, принятие решений — в общем, является центром нашей личности. Память и осознание себя — это то, что мы и называем «собой». То, чем мы отличаемся друг от друга. И может ли быть совпадением, что именно в этих участках мозга создаются наилучшие условия для накопления отличий от «стандартной комплектации генома»? Поэтому ученые предполагают, что разнообразие человеческих личностей частично может быть основано на генетическом разнообразии наших мозгов, возникшем именно за счет размножения и прыжков «мусорной ДНК».
Что именно меняется в мозге за счет генетического перемешивания с помощью L1? Этого точно никто пока не знает, зато предположения строятся очень многообещающие. Сейчас ты можешь перечитать предыдущую главу, где описаны типичные последствия транспозонных прыжков, и пофантазировать на эту тему. А предположения ученых будут описаны в главе о генетическом разнообразии в человеческом мозге.
Третья, и последняя группа «прыгающих генов» называется ДНК-транспозонами. У человека они занимают меньше трех процентов генома, но это совсем не значит, что они для нас не важны. На самом деле с активностью именно этой группы ты сталкиваешься в повседневной жизни чаще всего, и они могут существенно влиять на тебя прямо сейчас. Помнишь про такую функцию «мула», которую может выполнять транспозон — когда в него встраивается обычный клеточный ген и при прыжках транспозона расползается по геному вместе со своим переносчиком? Так вот именно ДНК-транспозоны чаще всего бывают такими «мулами»… Но не у нас. А у бактерий, в том числе тех, которые населяют все поверхности и внутренности твоего тела.
Именно ДНК-транспозоны являются частью механизма горизонтального переноса генов, который позволяет бактериям обмениваться полезной информацией типа гена устойчивости к какому-нибудь антибиотику, с помощью которого мы пытаемся избавиться от всяких излишне размножившихся в горле стафилококков. Такие полезные для выживания бактерий штуки очень быстро распространяются между разными их видами, и даже если именно в твое тело какой-то антибиотик никогда не попадал, то несмотря на это твои бактерии вполне могут уже обладать геном устойчивости к нему. Ведь им не нужно самим его «изобретать», достаточно чтобы в тебя попал хоть какой-нибудь его обладатель и поделился с соседями. При активном содействии ДНК-транспозона конечно. Так что возможно тот самый стафилококк, который ты пытаешься придушить антибиотиком, уже чихать на него хотел. Точнее, чихать будешь ты, помогая этому устойчивому гаду распространяться.
Приобретение бактериями устойчивости к антибиотикам может быть пользой не только для них, но и для нас. Например, вернемся к попавшему в твое горло и излишне размножившемуся стафилококку. Если живущие в тебе бактерии-симбионты устойчивы к антибиотику, которым ты пытаешься убить создающего проблемы вторженца, а он такое полезное свойство пока не приобрел, то лечение будет вполне эффективным. Стафилококк исчезнет, а необходимая тебе микрофлора останется нетронутой.
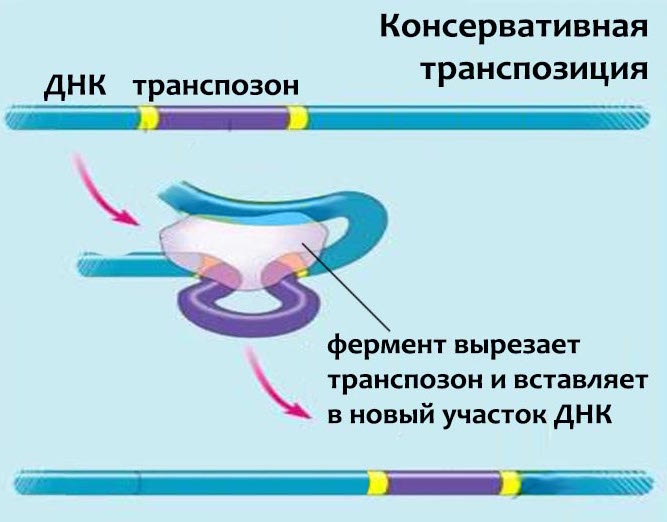
Если первые две группы транспозонов размножаются только с помощью копирования себя (репликативно), то ДНК-транспозоны чаще всего используют консервативную транспозицию. То есть передвигаются они по геному методом «вырезать и вставить», не увеличивая общее количество своих копий, или увеличивая его незначительно. В человеческом геноме они чаще всего неактивны: возможно, нам чем-то неудобно использовать именно эту группу транспозонов, поэтому они безвозвратно теряют свои функции и занимают такую небольшую часть нашей ДНК.
Зато в растениях именно этот вид транспозонов наиболее активен: например, в переживающей трудные времена (типа засухи) кукурузе запускаются мощные перестройки генома с помощью ДНК-транспозонов. Такой шквал мутаций конечно несет существенную степень риска, но учитывая, что некоторые получившиеся генно-модифицированные зерна могут случайно получить заметное преимущество в новых условиях и дать начало целой популяции засухоустойчивой кукурузы, оно того стоит. Еще такая кукуруза может получиться очень красивой, как на фото слева.
Итак:
? Граница между транспозонами и ретровирусами довольно размыта. Между ними очевидны родственные связи, и ученые все еще выясняют, кто же от кого произошел. Про это подробнее — в следующей, факультативной главе.
? Транспозоны конечно же не являются «абсолютным добром»: их прыжки могут приводить (и приводят) к проблемам для содержащего их организма. Некоторые заболевания связаны именно с ними. При этом клетка пытается минимизировать вероятность вреда и при этом сохранить в геноме мобильные генетические элементы: чаще всего они надежно заблокированы, и разблокируются только тогда, когда их активность будет выгодна всему организму.
? Большинство транспозонов находятся в неактивной форме из-за множества произошедших в них мутаций. Они не могут создавать свои копии или перемещаться в пределах генома, или служить чертежами для построения каких-то клеточных продуктов. Многие такие «выключенные» транспозоны жизненно необходимы клетке: например, из них состоят теломеры и центромеры.
? Если раньше считалось, что за разнообразие человеческих личностей и способностей отвечают только унаследованные от предков гены и влияние окружающей среды, то сейчас начинают исследовать третий возможный фактор влияния: генетическое разнообразие клеток мозга, где наследственная информация перестраивается за счет активности «прыгающих» транспозонов. Мало того, что невозможно предсказать влияние на развитие человека бесконечно огромного количества факторов внешней среды, тут еще добавляется вероятностный процесс: много ли транспозонов активируются, в какие места генома они встроятся.. Сверхбесконечные возможности для создания разнообразия мозгов.
Для тех, кто всерьез заинтересовался этими прыгающими по геному штуками, в транспозоновой факультативной главе будет бонус: подробный разбор того, из чего они состоят и как копируются, как встраиваются в геном и как переносят в новые места обычные для организма гены, как именно организм контролирует свои мобильные элементы. А также выяснение, кто из пары «транспозон — ретровирус» является курицей, а кто яйцом.