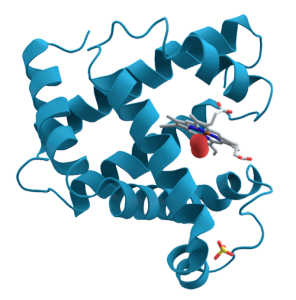Теперь, когда получена необходимая предварительная информация, можно наконец сказать несколько слов и о протеине под названием миоглобин ( myoglobin [mʌɪə’gləʊbɪn] ). Миоглобин содержится в «красных мышцах» — в скелетных мышцах и в сердце. Он занимается запасанием кислорода, который так необходим мышцам для их работы. В условиях, когда возникает дефицит кислорода (например при активной физической нагрузке), кислород высвобождается из миоглобина и поступает в «энергетические станции» мышечных клеток — в митохондрии, где с помощью этого кислорода и осуществляется синтез универсальных «аккумуляторов» — АТФ.
Миоглобин представляет собой компактную, почти сферическую молекулу размером 4,5 х 3,5 х 2,5 нанометра. В его состав входит 153 аминокислотных остатка. Вся эта цепочка аминокислотных остатков свернута в восемь спиралей, имеющих обозначение от латинской буквы A до буквы H. В зазоре между спиралями E и F расположен тот самый гем b, о котором мы теперь уже знаем. На рисунке он есть.
Каждый конкретный аминокислотный остаток, входящий в состав миоглобина, имеет собственное обозначение: сначала идет буква, обозначающая спираль, а потом порядковый номер в этой спирали. Например His F8 обозначает восьмой остаток в спирали F, которым является гистидин. Внутри миоглобина гем не просто болтается в щели между спиралями E и F, но прочно связан химической связью с His F8 и His E7. Как гимнаст вцепляется двумя руками в кольца и висит между ними, так и гем хватается за имидазольные кольца [молекул гистидина], торчащие из спиралей E и F.
О миоглобине еще можно сказать, что его молекулы, содержащиеся в скелетных мышцах, и молекулы, содержащиеся в сердце, немного отличаются, и в медицине этот факт используется для выявления инфаркта миокарда по появлению специфического «сердечного» изотипа миоглобина в крови.
В нормальных условиях, в отсутствие повреждения или воспаления мышечной ткани, миоглобин в кровь не попадает совсем. Подобно гемоглобину, миоглобин высокотоксичен при его нахождении в свободном состоянии в плазме крови: его крупные молекулы могут закупоривать канальцы почек и приводить к их некрозу. Кроме того, если миоглобин попадает в кровь, то он начинает конкурировать с гемоглобином, содержащимся в эритроцитах, и связывать кислород в лёгких, при этом не будучи способным выполнять функцию отдавания кислорода тканям. Таким образом свободный миоглобин в крови ухудшает кислородное снабжение тканей и приводит к развитию тканевой гипоксии. Самоотравление организма свободным миоглобином и как следствие острая почечная недостаточность и тканевая гипоксия — одна из главных причин смерти при синдроме длительного сдавления (краш-синдром), встречающемся при тяжелых травмах со сдавлением или размозжением значительных количеств мышечной ткани.
В отличие от миоглобина, молекулы гемоглобина не выполняют функции накопления и удерживания кислорода про запас, зато они выполняют две другие важнейшие функции:
1. переносят кислород из легких к периферическим тканям
2. переносят углекислый газ и протоны с целью выведения их из организма — от периферических тканей к лёгким.
Гемоглобин — существенно более сложная молекула, чем миоглобин, так что оставим это на потом.