Обычно информация такой степени углубленности, как в этой главе, дается где-нибудь в середине толстого и потрепанного университетского учебника по биохимии. Причем в очень сжатой форме, ведь для тех, кто осилил все подготовительные этапы, необходимые для прочтения этого талмуда, «все тривиально», и им должно быть достаточно самого общего описания этого процесса. Но вот этого «должно быть» на самом деле никогда не бывает: университетские и школьные программы построены так, что студенты впихивают в себя огромные объемы информации в сжатые сроки, чтобы сдать очередной экзамен. И даже те из них, кто заинтересован в своем предмете и пытается в нем разобраться, добиваясь глубокого понимания деталей, сдаются. Потому, что у них просто нет возможности пару дней собирать информацию про какое-нибудь «изменение конфигурации молекулы А, в результате которой она может выполнять все те действия, про которые я читаю». И потому, что просто нет этой информации вот в таком разжеванном виде.
А на такой степени углубления начинается самое интересное! Например, описания того, как ничтожная концентрация адреналина в крови влияет на огромное количество клеток твоего организма, мгновенно изменяя их метаболизм (то есть обмен веществ — расщепление одних молекул и создание других) и вызывая все те ответы на неожиданно шлепнувшую тебя по попке подружку, которые ты в себе различаешь — а также те, которые ты различить не способна. Поэтому здесь я поставила себе интересную задачу: описать один из путей передачи сигнала между клетками, причем так, чтобы почти не разбирающийся в генетике и молекулярной биологии человек смог получить о нем такое вот общее представление. Перед этой главой очень желательно прочитать первую биохимическую главу, чтобы иметь представления о том, как происходит использование АТФ в этих процессах, ну и просто стоит туда подсматривать, натыкаясь здесь на разные термины.
Есть такая штука, как реакция «Бей или беги» (на английском это звучит прикольнее — Fight-or-flight response ). Этот термин обозначает совокупность реакций организма на стресс, причем эти реакции затрагивают весь организм в целом, развиваясь синхронно и молниеносно. Ты сама это испытывала столько раз, что кажется естественной (а значит, и не удивительной) вот эта самая молниеносность и всеобъемлемость. Но стоит задаться вопросом: как же так получается, что стоит твоим органам чувств воспринять угрозу, как ВСЕ находящиеся от них далеко на периферии органы на нее реагируют — и ты понимаешь, что ответа на него нет. Ну это у тебя его нет, а на самом деле он есть:), и именно с этим вопросом мы сейчас и начнем разбираться.
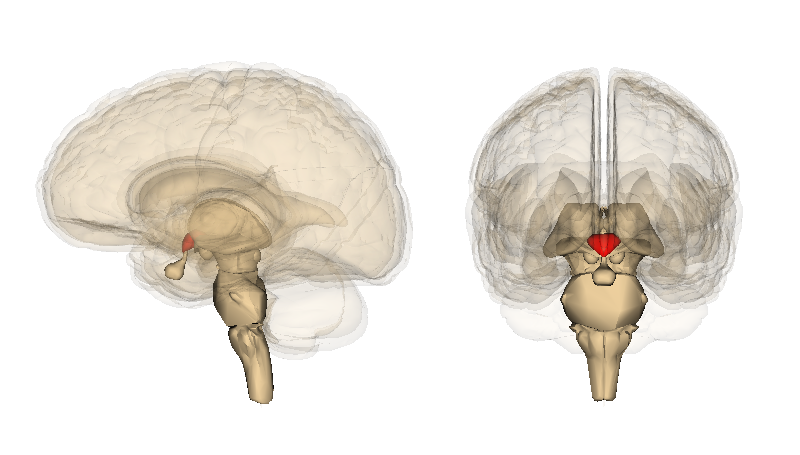
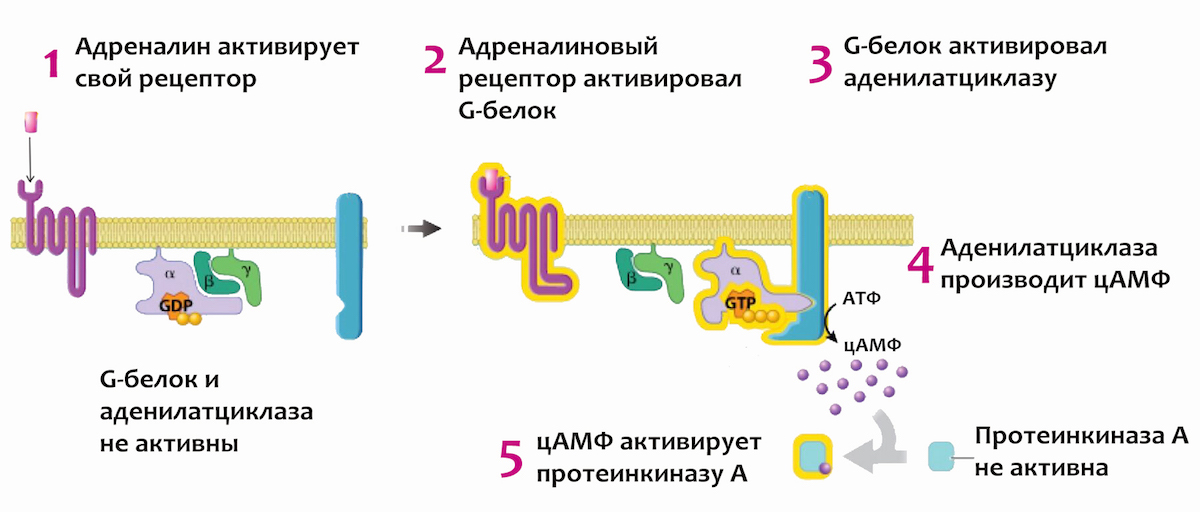
Итак, ты увидела.. ну пусть медведя. Не в цирке, а на прогулке в лесу. Зрительный сигнал попал в гипоталамус — ту часть мозга, которая управляет всеми гормональными реакциями. Это очень мелкая и очень глубоко запрятанная штука, поэтому на схеме справа окружающие ее части мозга нарисованы полупрозрачными. Он активировал надпочечники, послав им химический сигнал через кровь. А надпочечники выбросили в кровь адреналин — вот это слово тебе наверняка знакомо.
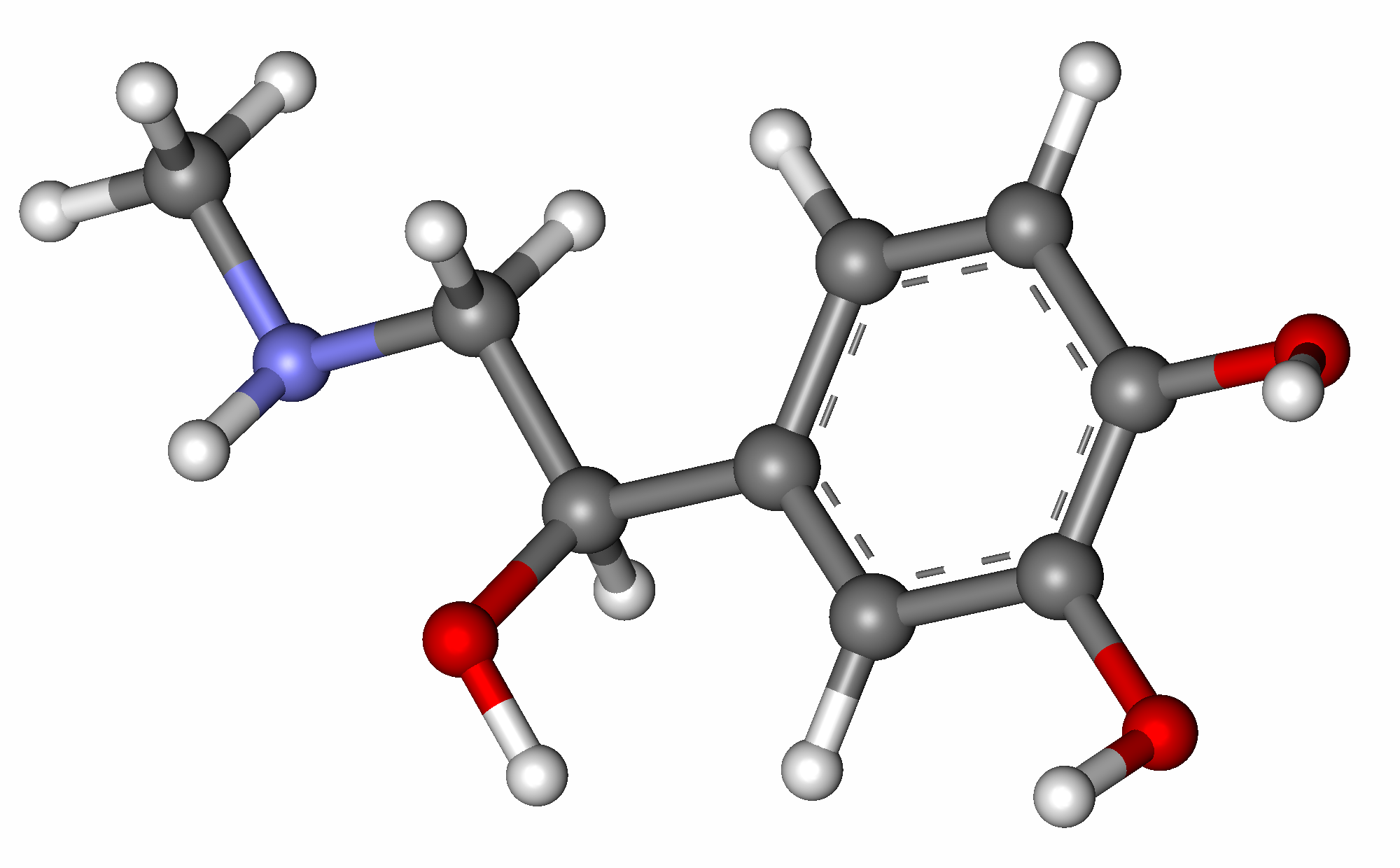
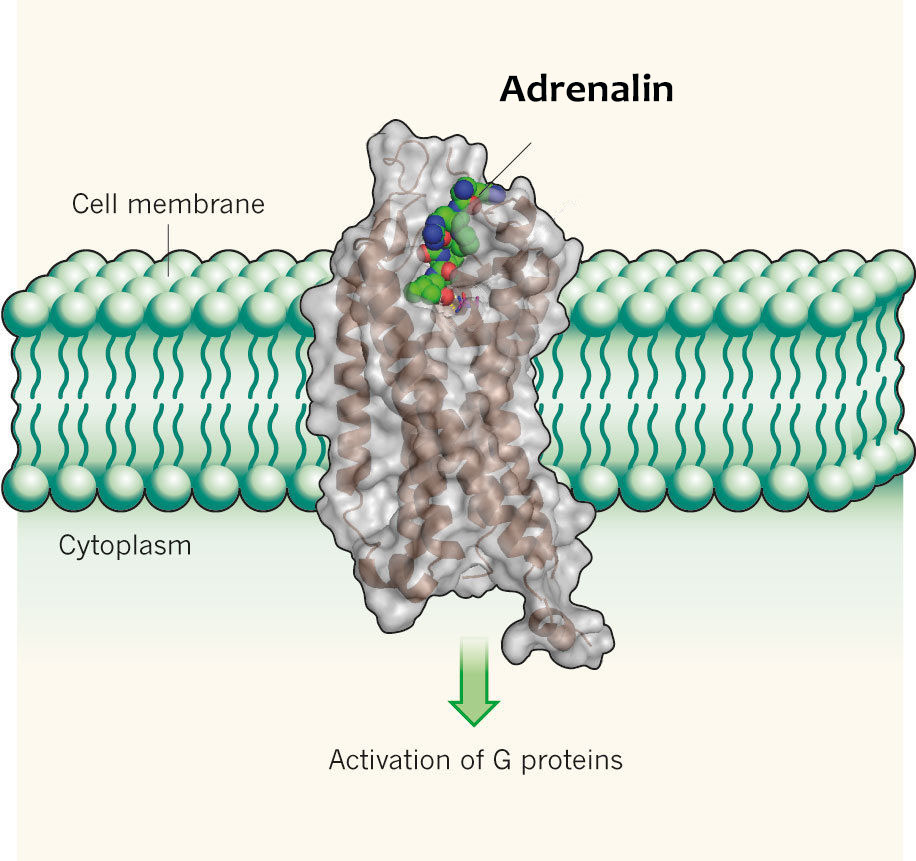
Адреналин — это гормон, то есть небольшая сигнальная молекула, выпускаемая в кровоток и плывущая на поиски клеток, которые на этот сигнал реагируют. Чтобы клетка среагировала на гормон, в ее мембране должен быть подходящий именно к этому гормону рецептор. В кровотоке находится огромное количество молекул, в том числе и разных гормонов, поэтому важно чтобы рецептор не реагировал на что попало, а подходил к своему гормону, как замок к ключу.
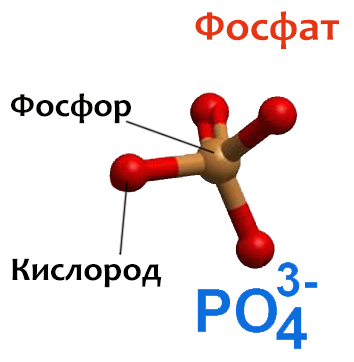
Рецепторы — это протеины, встроенные в клеточную мембрану так, чтобы торчать с обеих ее сторон: с внешней стороны находится место связывания лиганда (так называют в биохимии мелкие молекулы, которые связываются с крупными, например для передачи сигнала), а с внутренней стороны расположена система, передающая полученный сигнал внутри клетки. В прошлой биохимической главе я подробно описывала то, как на конфигурацию протеина влияет присоединение фосфата — отрицательно заряженной молекулы из пяти атомов. А в молекуле адреналина атомов гораздо больше, так что ее присоединение тоже оказывает существенное влияние на то, как протеин рецептора сворачивается, как одни его части расположены относительно других. Причем это влияние затрагивает не только внеклеточную часть протеина, где адреналин присоединился, но и внутриклеточную. И это логично, иначе как бы сигнал передался внутрь клетки и зачем бы нужно было всю эту систему устраивать?
Итак, адреналин присоединился к рецептору и активировал его, передав таким образом сигнал от бесконечно далеко (ну, по клеточным меркам) расположенных надпочечников прямо внутрь клетки. А дальше что?
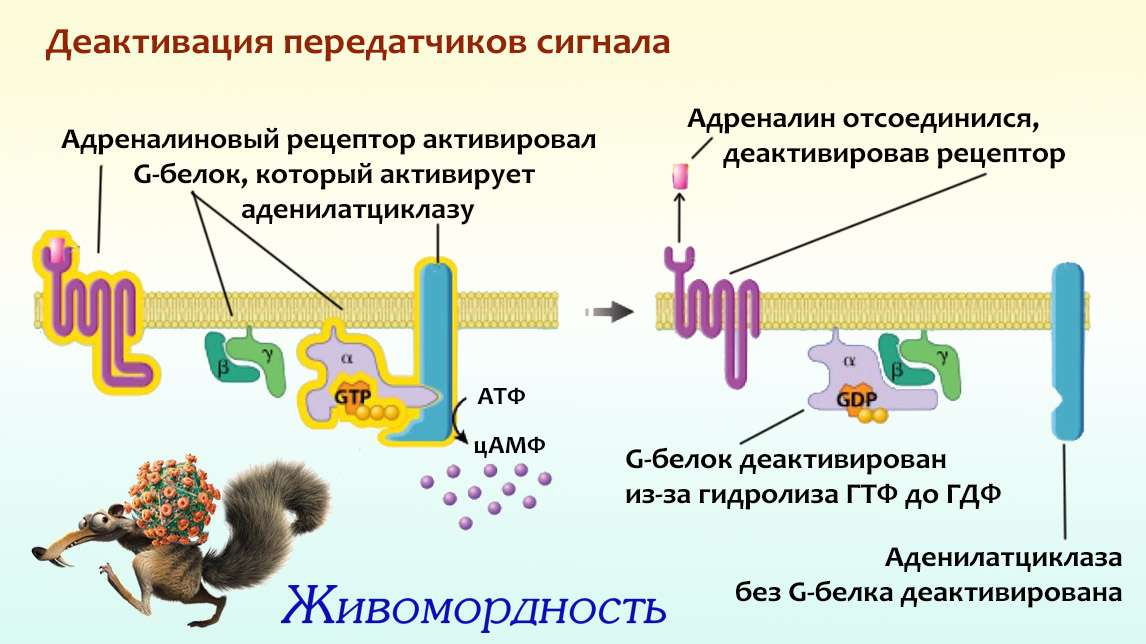
А дальше в игру вступает другой протеин, который называется G-белок. Обычно он плавает вдоль внутренней стороны клеточной мембраны, потому что одна его часть представляет собой встроенный в эту мембрану «якорь». Про то, как и зачем протеины присоединяются к мембране, можешь прочитать в этой главе. Пока клетка не получила адреналиновый сигнал, G-белок деактивирован: это означает, что к нему в качестве «заглушки» присоединена молекула рибонуклеотида ГДФ (гуанозиндифосфата). Все, что тебе сейчас нужно знать про эту молекулу — это то, что она не может дать G-белку ничего полезного:), и не дает присоединиться к нему другой молекуле, которая этот G-белок сделает активным. А если хочется немного подробнее вникнуть в происходящее, то можешь пролистать прошлую биохимическую главу. Тогда станет ясно, что «рибонуклеотид ГДФ» с биохимического языка переводится как «нуклеотид, в котором содержатся
* азотистое основание гуанин
* сахар рибоза
* и всего лишь два фосфата».
Теперь, когда ты знакома с G-белком и его заглушкой, можно возвращаться к молекуле адреналина, активировавшей свой рецептор. Его нижняя часть ждет контакта именно с G-белком, и когда они наконец встречаются, адреналиновый рецептор его активирует. Это значит, что G-белок выпускает наконец бесполезный ГДФ, и на его место вставляется ГТФ, или гуанозинТРИфосфат (этот момент ты видишь на схеме внизу). Нуклеотид, имеющий целых три фосфата (на схеме слева они красно-оранжевые), бесконечно отличается от того, у которого фосфатов всего два. Потому что:
* связь между вторым и третьим фосфатом при разрушении выделяет большой запас энергии, который клеточные машинки умеют перехватывать и использовать для своих целей
* сам этот третий фосфат тоже может быть пущен в дело в тот момент, когда его откусывают и получают свободную энергию.
Когда активированный G-белок соединяется с ГТФ, он берет и … разваливается на две части. Немного неожиданный вариант развития событий:). Одна из частей — слепленные вместе β- и γ-субъединицы G-белка — уплывает из поля нашего интереса, а вторая играет главную роль в дальнейшей передаче сигнала. Это α-субъединица, на которой и находится тот «карман», в котором закреплена молекула ГТФ.
Давай еще раз остановимся на том, что произошло:
1. одна молекула адреналина активировала один адреналиновый рецептор
2. адреналиновый рецептор активировал G-белок, и тот уплыл вдаль
Но рецептор адреналина остался после этого активированным, а значит может сделать активными и другие подплывающие к нему G-белки. Это первое усиление сигнала, переданного клетке: в результате действия всего одной молекулы адреналина будет активировано множество G-белков. Каждый из которых не сидит на месте, а плывет по поверхности клеточной мембраны, пока не натыкается на фермент аденилатциклазу (этот момент ты видишь на схеме вверху, в ее правой части). Пока этот фермент болтается в мембране в одиночестве, он ни на что не способен. Но с присоединенной α-субъединицей G-белка он активируется, и приступает к выполнению своей функции: берет молекулы АТФ (аденозинтрифосфата, которому была посвящена предыдущая биохимическая глава), и делает из них немного отличающиеся молекулы: цАМФ, или циклический аденозинмонофосфат. Нет необходимости вникать в подробности того, что это за молекула — главное, что тебе стоит запомнить, что на этом этапе сигнал опять усиливается. Потому что одна аденилатциклаза может наштамповать ТЫСЯЧИ молекул цАМФ. А эти молекулы уже не привязаны к мембране и расплываются по клетке в поисках фермента, который они активируют, чтобы передать сигнал дальше.
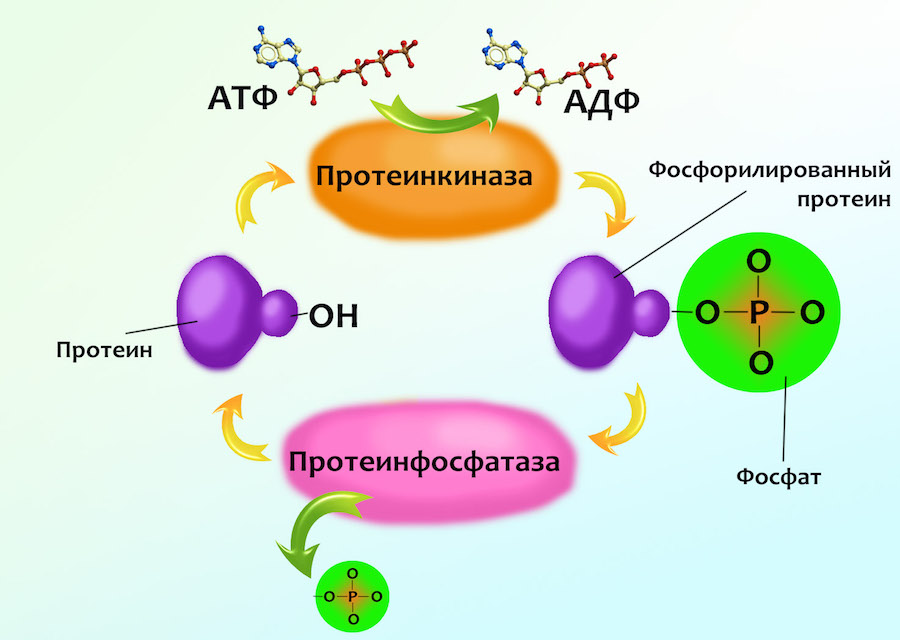
Да, это еще не конец сигнального пути — фактически, мы добрались только до середины. Потому что мишени молекул цАМФ не являются конечным получателем сигнала, а служат еще одним его усилителем. Эти усилители называют цАМФ-зависимые протеинкиназами, или протеинкиназами А (буква «А» здесь указывает на активацию циклическим Аденозинмонофосфатом, а не чем-то еще). С этими животными мы еще не сталкивались, но на самом деле ты уже кое-что про них знаешь. Помнишь, в прошлой главе подробно разбиралось, как и зачем к протеину присоединяется отрицательно заряженная молекула фосфата? Вот именно этим и занимаются протеинкиназы: берут протеин и молекулу АТФ, отделяют от АТФ один из фосфатов, превращая его в АДФ, и этот фосфат прикрепляют к протеину. Отпускают все эти молекулы и идут на поиски следующего протеина, и еще одного, и еще — пока протеинкиназа активирована, она будет фосфорилировать один протеин за другим. Конечно же, не какой попало протеин, а нужный. Как любой другой фермент, протеинкиназа имеет сайт связывания — то место, к которому прикрепляется ее субстрат (так называют молекулы, с которыми ферменты связываются для того, чтобы их изменить). И этот сайт связывания имеет такую форму и электрические заряды на своей поверхности, что присоединиться к нему может только протеин определенной формы, имеющий нужное расположение зарядов. Получается опять такая же система «ключ — замок», как у сигнальных молекул и их рецепторов.
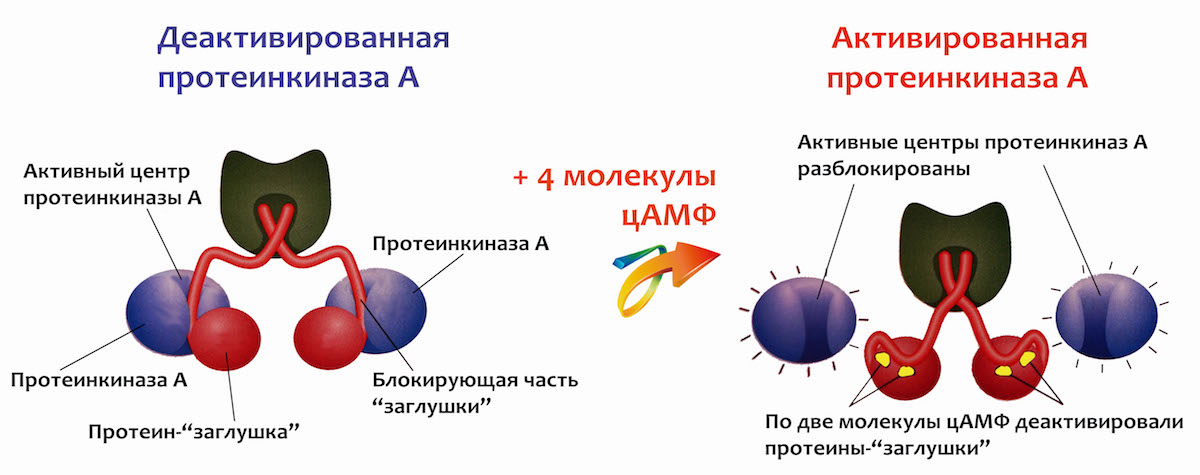
Этот сайт связывания протеинкиназы — как раз удобная мишень, чтобы ее выключать. Достаточно засунуть туда что-то, похожее на молекулу субстрата, и деактивированная такой «заглушкой» протеинкиназа остается надежно выключенной. На картинке внизу в левой части ты видишь такую пару заглушек, в каждую из которых вцепилось по одной протеинкиназе А. Но такая картина наблюдается только тогда, когда в клетке нет молекул цАМФ. А как только в результате активации адреналином они начинают производиться, к каждой «заглушке» прилипает по паре этих молекул. В результате петли заглушек, заменяющие собой субстрат протеинкиназы, больше не могут играть роль застрявшего в замке ключа, и протеинкиназы освобождаются.
Давай еще раз подробнее рассмотрим это самое фосфорилирование протеина и разберемся — почему в клетках так много разных протеинкиназ, которые могут работать с разными протеинами. Их там на самом деле ОЧЕНЬ много, а значит, вникнув в механизм работы одной протеинкиназы, ты будешь иметь представление о работе всех остальных. И когда ты будешь читать про следующую протеинкиназу, это смутное представление активизируется, сделав все гораздо более понятным.
Ты уже знаешь, что фосфорилирование меняет форму протеина, а это изменение формы меняет его активность: если до сих пор протеин был не способным выполнять свою функцию, то есть был пассивным, то фосфорилирование его активирует. И наоборот — в работающем протеине присоединенная «лишняя» молекула фосфата нарушает его конфиругацию так, что он перестает работать. На картинке слева ты видишь схему такого включения протеина с помощью фосфорилирования. Выключение выглядит точно так же — только «красная лампочка» активности загорается на той молекуле протеина, к которой НЕ присоединен фосфат.
Из-за этой возможности моментальной активации и деактивации в случае, когда в клетке нужно запустить какой-то сигнал, включив или выключив протеин, его не приходится создавать с нуля — он уже там плавает, готовый к использованию, осталось только натравить на него протеинкиназу. С одной стороны, получается, что в клетке постоянно находятся огромные количества таких протеинов и их протеинкиназ, которые прямо сейчас не используются. Кажется неоправданным занимать ограниченный объем клетки этим «балластом». С другой стороны, если представить, что их там нет, то тоже получается как-то не очень удобно. При передаче сигналов внутри клетки счет идет на миллисекунды (вспомни про медведя), а процесс производства протеина — дело не быстрое: нужно считать ген, создав матричную РНК, перетащить ее из ядра в цитоплазму, построить по ней протеин, помочь ему принять нужную форму.. Если бы сигналы передавались именно так, то медведь бы уже тобой поужинал. Вместо этого сначала активируется множество ожидающих своего часа протеинкиназ — ты же помнишь, что в результате получения адреналинового сигнала производится очень много цАМФ? Так вот, для активации одной протеинкиназы А нужно всего лишь две таких молекулы, так что получается неплохое усиление сигнала. Неплохое, но все еще недостаточное, поэтому каждая активированная протеинкиназа будет «включать» (или «выключать») каждый подходящий ей протеин, на который она наталкивается, пока ее не выключат. Таким образом сигнал усилится еще в несколько раз.
Какой протеин будет мишенью протеинкиназы А, активируется он или наоборот, зависит от конкретной клетки: ты же не ожидаешь, что на адреналиновый сигнал и клетки желудка, и клетки мышц будут реагировать одинаково? Чтобы не расползаться по всему организму, давай сосредоточимся на том, что происходит в клетках печени при запуске реакции «Бей или беги» (смотри схему внизу):
0. Эти клетки, как и клетки других органов, получили сигнал в виде адренолиновых молекул.
1. Адреналиновые молекулы активировали свои рецепторы в мембранах клеток (одна молекула активирует один рецептор.
2. Каждый активированный адреналиновый рецептор активировал несколько G-белков, плавающих на внутренней поверхности клеточной мембраны (то есть сигнал снаружи попал внутрь клетки и умножился, ведь один рецептор включил много G-белков).
3. Каждый активный G-белок активировал одну аденилатциклазу.
4. Каждая аденилатциклаза начала производить много молекул цАМФ (еще одно усиление сигнала).
5. Молекулы цАМФ расплываются по клеткам и активируют протеинкиназы А.
И тут наша прямая линия передачи сигнала разветвляется. Потому что в клетках печени есть ДВА протеина-субстрата для протеинкиназы А. Оба этих субстрата протеинкиназа фосфорилирует, при этом один выключается, а другой становится активным. И такая одновременность не случайна, а наоборот очень даже оправдана, что станет понятно, когда мы разберемся с обоими этими субстратами.
Первый из этих протеинов называется GP-киназа ( Glycogen phosphorylase kinase = GP kinase) — да, опять протеинкиназа! А значит, сигнал опять будет усилен, ведь каждая GP-киназа фосфорилирует не один протеин, а несколько. Больше про них собственно и нечего сказать: получили сигнал и передали его, умножив при этом. А вот тот фермент, на который направлена их активность, уже не просто очередной передатчик, так что на нем остановимся подробнее.
GP-киназы фосфорилируют гликоген-фосфорилазу ( Glycogen phosphorylase ), которая уже не передает сигнал куда-то, а выполняет тот процесс, ради которого вся эта передача и начиналась. Гликоген-фосфорилаза разрушает молекулы гликогена, производя при этом молекулы глюкозы. С глюкозой ты наверняка знакома — это очень эффективный источник энергии, поэтому вполне логично начать ее производить именно в тот момент, когда нужно мобилизовать все силы, чтобы удирать от медведя (ну или чтобы с ним бороться, смотря какие там у тебя силы и чувство собственной важности). А гликоген — это всего лишь удобный способ держать вместе молекулы глюкозы, соединив их в длинные цепочки. Очень красиво выглядит схема цепочек гликогена, собравшихся вокруг гликогенина — одного из протеинов, который их строит.
Молекулы глюкозы не просто так собираются клеткой в перерывах между битвами с медведями в цепочки гликогена: если глюкоза будет бесконтрольно плавать по клетке, то она будет расходоваться просто потому, что расщепляющие ее ферменты могут до нее добраться, и запасенная в ней энергия будет выделяться впустую. А из гликогена эти ферменты глюкозу не выкусят, и только в нужный момент, после передаче соответствующего сигнала, гликоген-фосфорилаза начнет отщипывать глюкозу одну за другой и отдавать «на съедение» ферментам, которые уже добудут из нее энергию.
В случае глюкозы, запасенной в печени, все немного сложнее: употреблять ее будут не только клетки печени, но и мышечные клетки, в которые она попадет через кровь (конечно же после того, как клетки печени эту глюкозу туда выбросят). Печень как раз для таких случаев запасает побольше гликогена, и его концентрация там намного выше, чем в других органах. У взрослого человека там может накопиться больше ста граммов таких «энергетических консервов».
Но клетка должна не только начать разрушать молекулы гликогена в ответ на адренолиновый сигнал — в это же время она должна прекратить их строить. Иначе энергия на разрушение гликогена будет тратиться впустую, и необходимого большого выброса глюкозы в кровь не произойдет. Поэтому та же самая активированная протеинкиназа А, которая запустила разрушение гликогена, выключает тот протеин, который этот гликоген создает. Этот протеин называется гликоген-синтаза ( Glycogen synthase ), и он относится к тому виду протеинов, которые фосфорилирование делает неактивными. Поэтому несмотря на то, что один и тот же фермент (протеинкиназа) действует на оба субстрата (GP-киназу и гликоген-синтазу) одинаково, присоединяя фосфат, результаты этого действия противоположны: один активируется, а другой выключается.
Вот в общем и все — сигнал, переданный адреналином, достиг наконец своих получателей:
1. фермент, запасающий глюкозу, прекратил свою деятельность
2. фермент, добывающий глюкозу из этих запасов, активизировался и позволил клетке печени выбросить в кровь множество молекул глюкозы.
На первый взгляд кажется, что такие простые действия, как активация двух ферментов, не стоят такого сложного пути передачи сигнала через нескольких посредников. Но это очень поверхностное видение ситуации не учитывает два момента:
1. На некоторых этапах передачи сигнала происходило его усиление. Пока ты не имела возможности оценить его масштабы, а теперь можешь узнать и восхититься: одна молекула адреналина, связавшаяся с рецептором, приводит к выбросу ДЕСЯТКОВ ТЫСЯЧ молекул глюкозы. Именно поэтому выброшенное в кровь ничтожное количество молекул гормона приводит к такому массированному и быстрому ответу каждого заинтересованного органа, ведь усиление сигнала с помощью такого каскада активаций-деактиваций происходит в любой клетке.
2. Ежесекундно клетка получает не один сигнал, а бесчисленное множество. Это и сигналы извне, переданные с помощью рецепторов и других молекул-передатчиков. И сигналы изнутри — ведь происходящие в клетке процессы влияют друг на друга. И если каждый из этих сигналов будет непосредственно в один этап передаваться своему получателю, то это приведет к нерегулируемому хаосу: один рецептор запускает производство гликогена, в это же время другой запускает его разрушение, а третий делает что-то еще свое… Зато когда несколько сигналов передаются через такие вот многоступенчатые пути, они влияют друг на друга и фактически суммируются клеткой. В результате не просто побеждает тот сигнал, который оказался сильнее — он оказывается существенно скорректирован другими поступившими извне и возникшими внутри клетки сигналами.
Казалось бы, с передачей сигнала адреналином теперь все ясно. Но на самом деле мы не касались пока очень важного момента — того, как этот сигнал прекращает свое действие. Своевременное выключение любого сигнала не менее необходимо, чем его адекватное включение. В случае с сигналом, который передавает адреналин, это жизненно важно: во время реакции на адреналин организм работает «на износ», активно расходуя ресурсы, приостанавливая необходимые процессы жизнедеятельности, чтобы высвободить энергию на попытку своего спасения. Очевидно, что этот режим должен включаться только по необходимости, и выключаться сразу же, как только он больше не нужен.
Раз самые разные молекулы производились и активировались, чтобы передавать этот сигнал, именно они могут быть разрушены и деактивированы, чтобы его же остановить. И такая деактивация на разных этапах передачи обеспечивает ту самую гибкость настройки под окружающую среду, которой отличаются процессы наших клеток.
1. Получив сигнал, что опасности больше нет, гипоталамус прекращает выброс гормонов, активирующих надпочечники. А надпочечники в свою очередь прекращают выброс адреналина.
2. Все эти гормоны в крови разрушаются очень быстро — например, через 1 — 2 минуты после выброса адреналина половина молекул уже разрушена.
3. Адреналин со своим рецептором связывается непрочно, но если в крови его много, то проблем с передачей сигнала не возникает: одна молекула отцепилась — найдется другая, которая займет ее место. А вот когда его концентрация в крови падает, рецептор скорее всего остается одиноким — и выключенным. А значит, никакие G-белки он больше не тронет и не активирует. Но если он их уже включил и больше никак на них не влияет, то как же они будут выключены?
4. Оказывается, в своем выключении G-белок проявляет собственную активность: α-субъединица, заполучившая активировавшую ее молекулу ГТФ, через какое-то время берет и откусывает от нее один фосфат. В результате к ней присоединен теперь уже ГДФ, и она не может больше быть активной. А значит α-субъединица отваливается от аденилатциклазы и воссоединяется с β- и γ-субъединицами. G-белок опять полностью собран и будет находиться в этом деактивированном состоянии до следующего сигнала. Обычно α-субъединица не торопится со своей деактивацией, и клетка может ускорить этот процесс: в результате уже другого сигнального пути активируются протеины, помогающие G-белку выключиться.
5. Уже понятно, что после деактивации G-белка одинокая аденилатциклаза опять выключена. Но в клетке продолжают плавать тысячи произведенных ей молекул цАМФ. Поэтому для их разрушения запускаются специальные ферменты, останавливая таким образом передачу сигнала.
6. Последнее звено сигнала — всякие фосфорилированные протеины — тоже не остаются без внимания при его выключении. На них натравливаются ферменты протеинфосфатазы ( Protein phosphatase ). Как ты не могла не догадаться по этому названию, объектом их интереса является присоединенный к протеинам фосфат. Этот самый фосфат протеинфосфатазой откусывается, возвращая протеины в их до-сигнальное состояние: включенные выключатся, деактивированные опять станут активными. В случае клетки печени это означает, что глюкоза опять начнет собираться в цепочки гликогена, на целостность которых больше никто не покушается.
Осилив эту главу, ты заложила прочную основу для того, чтобы с легкостью разбираться в особенностях передачи сигнала в очень разных клетках нашего организма, потому что с помощью G-белков и протеинкиназ передается ОЧЕНЬ много сигналов, в самых разных типах клеток. Конечно же, в каждом случае будут использоваться немного разные молекулы, и результаты сигнала будут очень разными, но сам принцип усиления сигнала с помощью такого каскада влияющих друг на друга молекул останется тем же. Поэтому если ты захочешь разбираться например в том, как именно наши органы чувств получают сигналы от окружающего мира, то ты сможешь опираться на то, что здесь прочитала.