Мы уже писали (https://goo.gl/J8Rehv) о том, что АНТИТЕЛА, или ИММУНОГЛОБУЛИНЫ — это молекулы, которые производит наш организм в ответ на попадание в него патогенов.
Задача антител состоит в том, чтобы прицепиться к какому-нибудь выступу патогена и таким образом:
* облегчить клеткам иммунной системы поиск патогенов и атаку на них
* мешать патогену в его жизнедеятельности (не очень удобно плавать, когда к хвосту, которым нужно грести, прицепилась тяжелая прищепка-антитело)
* связывание антитела с ТОКСИНОМ — веществом, повреждающим клетки — препятствует работе токсина. Некоторые патогены (вирусы или бактерии) сами по себе не причиняют больших неудобств, а вот продукты их жизнедеятельности являются такими токсинами, поэтому и иммунный ответ организма направлен прежде всего на нейтрализацию этих веществ.
Очевидно, что ключевой момент в этом процессе — связывание антитела с тем, что оно должно связать. Будет это связывание прочным — и патоген не уйдет. А если патоген будет легко стряхивать с себя антитела, иммунная система не справится с вторженцем, даже если организм активно производит все новые и новые способные бороться с ним клетки.
Так же очевидно, что организм не может иметь запас чертежей для создания антител «на все случаи жизни»: мало того, что вирусов и бактерий, способных принести вред, ОЧЕНЬ много — они еще и мутируют постоянно, и те «прищепки», которые отлично прицеплялись к прошлым версиям, бессильно скользят по патогенам следующих поколений.
Поэтому гены антител устроены таким образом, чтобы по ним могло создаваться невероятное разнообразие продуктов (но и это не единственный механизм, которым организм пользуется для эффективного иммунного ответа).
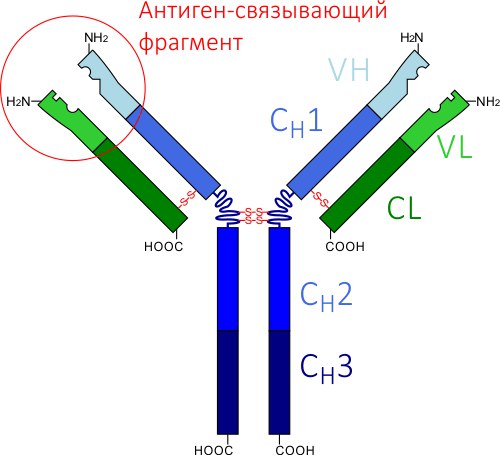
У антитела, которое ты видишь на картинке, есть две части:
* Первая часть (на картинке она расположена внизу) — это «тело прищепки», оно одинаковое у всех антител. Именно с телом взаимодействуют клетки иммунной системы, а они должны иметь возможность прикреплять любое из созданных организмом антител независимо от того, на какой выступ какой бактерии это антитело настроено.
* Вторая часть — это раздвоенная часть антитела (на картинке — вверху). И именно этими разветвлениями антитело присоединяется к выступу патогена. Они должны подходить к своей мишени как замочная скважина к ключу, или как одна деталь конструктора к другой, поэтому именно они являются самой изменчивой частью антитела.
Та часть ДНК, которая кодирует эту изменчивую часть антитела, состоит из большого количества похожих друг на друга фрагментов: в ней идут один за другим несколько вариантов первого фрагмента, несколько вариантов второго и так далее. Ты можешь видеть на второй картинке к посту три фрагмента V, два фрагмента D и т.д. — но для построения антитела необходимо использовать только один фрагмент каждого вида.
Если бы клеточные механизмы обрабатывали всю эту связку фрагментов ДНК и построили по ней белок, он не смог бы работать антителом и был бы как минимум бесполезен клетке. Такому варианту развития событий препятствуют механизмы регулирования считывания генов — и генетические тоже, но прежде всего эпигенетические.
Именно в результате их влияния считанная с ДНК длинная молекула РНК не переходит сразу же в то место, где по ней начнет строиться белок, а остается в ядре и подвергается АЛЬТЕРНАТИВНОМУ СПЛАЙСИНГУ (https://goo.gl/qsYDUV).
Результат этого процесса ты можешь увидеть на второй картинке к посту: из длинного гена создается короткая матричная РНК (мРНК), по которой и будет построена изменчивая часть антитела.
Если построить другую матричную РНК, в которой останутся другие варианты фрагментов, то она будет заметно отличаться от нашей первой мРНК, и построенные по этим двум мРНК белки будут иметь немного разную форму. За счет этого может получиться так, что первый белок зацепится за конкретный патоген лучше, чем второй — и тогда организм начнет производить огромное количество антител, построенных именно по той же первой схеме. Точнее, ПОЧТИ по той же схеме — ведь кроме альтернативного сплайсинга, иммунная система имеет еще один способ увеличивать разнообразие антител.
Этот способ заключается в активном мутировании «антительной» части ДНК в клетках иммунной системы, производящих антитела. Небольшие мутации приводят к тому, что построенные по одной и той же удачной схеме мРНК в разных клетках немного отличаются друг от друга. А значит, и антитела, которые будут по ним построены, будут иметь небольшие отличия — где-то выступ немного больше, в каких-то ямка немного глубже, где-то электрический заряд сильнее. И какой-то из этих вариантов будет лучше цепляться к нужному патогену, чем самый первый удачно прицепившийся. После этого именно такая мутировавшая модификация антител будет производиться активнее, из них будут отбираться те, что цепляются прочнее, и так далее — цикл за циклом иммунная система строит все лучше подходящие к патогену антитела, пока не побеждает его полностью.
Даже по этому очень поверхностному описанию понятно, что происходящие в клетках наших организмов процессы невероятно сложны и невероятно эффективны. Наверняка у многих людей возникает вопрос о том, почему эта наша уникальная иммунная система может не срабатывать, или срабатывать плохо, или вообще направлять всю свою мощь против клеток своего же тела, вызывая аутоиммунные заболевания. В последние годы появляется все больше исследований, доказывающих, что разнообразные заболевания иммунной системы, или просто ее пассивность и слабость, имеют своей причиной сбои в эпигенетической настройке. А тонкая настройка эпигенома очень сильно зависит от наших переживаний — о вреде стресса слышали все, но и слабые негативные эмоции, и фоновый низкоамплитудный стресс оказывают огромное негативное влияние на настройку эпигенома, сила деструктивной мощи которого очень недооценена (подробнее тут: https://goo.gl/j5Pqsc).