Эта глава возвращает нас к одному из главных клеточных процессов: синтезу протеинов по закодированным в генах чертежах. Общее представление о строении и функциях протеинов дает глава 12, а с главы 16 началось описание процесса их создания, или трансляции. Строение и функции рибосомы, самой крупной органеллы, участвующей в трансляции, описаны в отдельной главе учебника. Несмотря на то, что тРНК значительно мельче, рассказ о ее строении, особенностях и функционировании заслуживает отдельной главы.
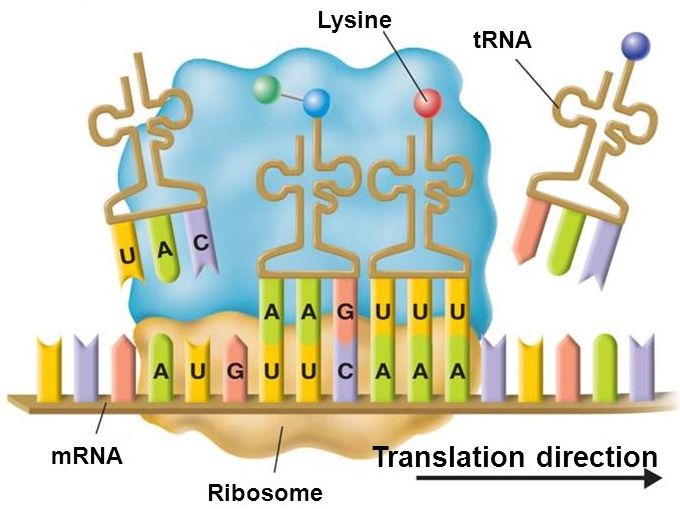
Итак, тРНК является «адаптером», который одним своим концом распознает трехбуквенную последовательность генетического кода, сопоставляя ей единственную соответствующую аминокислоту, закрепленную на другом конце тРНК. На прикасающемся к матричной РНК конце транспортной РНК находятся 3 нуклеотида, образующие антикодон. Только в случае комплементарности антикодона к участку мРНК транспортная РНК может к ней присоединиться. Но даже в этом случае тРНК не может присоединиться к мРНК самостоятельно, ей необходима помощь рибосомы, которая является местом их взаимодействия, а также активным участником трансляции. Например, именно рибосома создает связи между принесенными тРНК аминокислотами, формируя протеиновую цепочку.
Особенности строения тРНК обусловлены генетическим кодом, то есть правилами построения протеина по гену, которые транспортная РНК прочитывает. Этот код работает в каждом из живущих на Земле существ: создание вируса записано теми же трехбуквенными кодонами, которые используются для записи «инструкции по сборке» дельфина. Экспериментально проверено, что гены одного живого существа, помещенные в клетку другого, отлично копируются и транслируются в протеины, не отличимые от воспроизводящихся в клетках хозяина генов. На единообразии генетического кода основано производство колониями модифицированных кишечных палочек инсулина и многих других человеческих ферментов, использующихся в качестве лекарств для людей, чей организм не способен их вырабатывать, или вырабатывает недостаточно. Несмотря на очевидную разницу между человеком и кишечной палочкой, протеины человека легко создаются по его чертежам с помощью копировального аппарата кишечной палочки. Неудивительно, что транспортные РНК разных существ отличаются весьма незначительно.
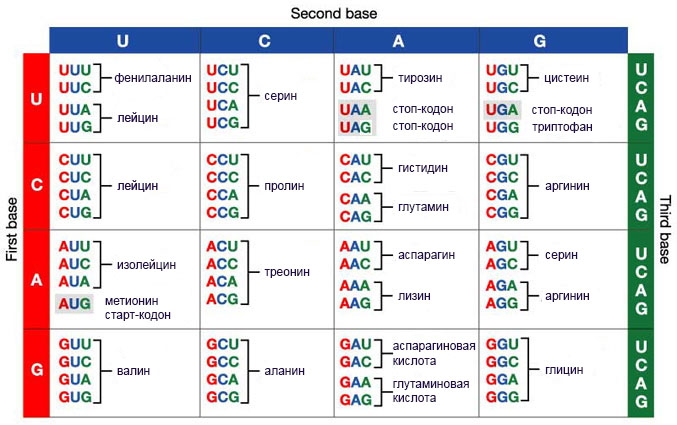
Каждый кодон из этого списка, за исключением трех стоп-кодонов, дающих сигнал о завершении трансляции, должен распознаваться транспортной РНК. Узнавание осуществляется с помощью присоединения к матричной РНК антикодона, который может связаться только с одним кодоном из списка, поэтому тРНК может распознать только один кодон. А значит, в клетке существует как минимум 61 вид этих молекул. На самом деле их даже больше, так как в некоторых ситуациях для считывания матричной РНК недостаточно просто иметь нужный антикодон: требуется выполнение других условий, в соответствии с которыми создается особая, модифицированная тРНК.
На первый взгляд, такое разнообразие тРНК должно существенно осложнять процесс трансляции: ведь каждая из этих молекул будет проверять подставленный ей рибосомой кодон матричной РНК на соответствие своему антикодону — казалось бы, столько бессмысленной механической работы, столько впустую затраченного времени и энергии. Но в результате эволюции сформировались также и клеточные механизмы, предотвращающие эту проблему. Например, количество тРНК каждого вида в клетке соответствует тому, как часто аминокислота, несомая этим видом, встречается в строящихся протеинах. Есть аминокислоты, которые редко используются клеткой, а есть часто использующиеся, и если бы количество несущих их тРНК было одинаковым, это значительно осложнило бы сборку протеинов. Поэтому «редких» аминокислот и соответствующих им тРНК в клетке мало, а часто встречающиеся производятся в большом количестве.
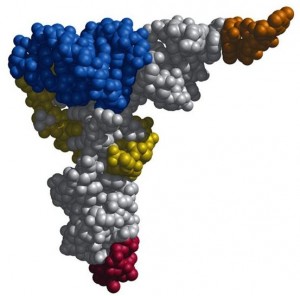
При таком разнообразии молекул тРНК все они очень похожи, поэтому рассматривая их строение и функции, в основном мы будем изучать общие для всех видов черты. Если взглянуть на трехмерную схему тРНК, она кажется плотным нагромождением атомов. Кажется невероятным, что эта сложнозакрученная молекула получена в результате сворачивания длинной цепи нуклеотидов, но именно так она и образуется.
Можно проследить этапы ее образования, начиная с самого первого: составления РНК-полимеразой последовательности нуклеотидов в соответствии с геном, содержащим информацию о данной транспортной РНК. Порядок следования друг за другом этих нуклеотидов и их количество называется первичной структурой тРНК. Получается, что именно первичная структура тРНК закодирована в гене, прочитываемом РНК-полимеразой. Вообще первичной структурой называют последовательность сравнительно простых молекул одного типа, из которых составлена более сложная, свернутая молекула-полимер. Например, первичной структурой молекулы протеина является простая последовательность составляющих ее аминокислот.
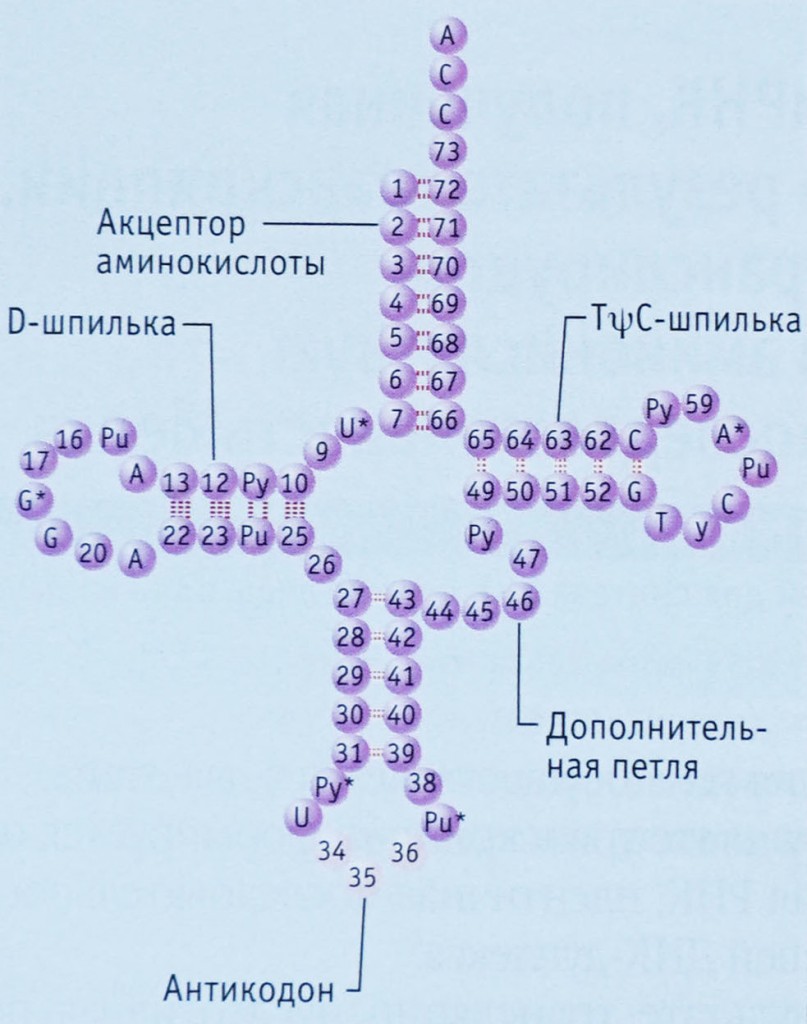
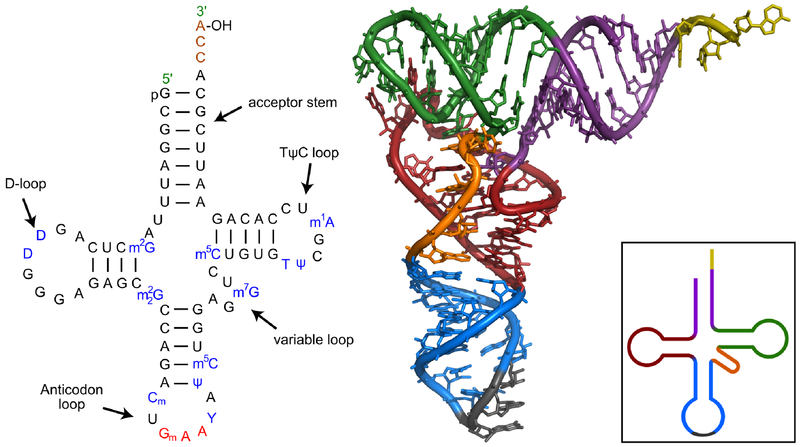
Любая цепочка нуклеотидов не может находиться в клетке в развернутом состоянии, просто вытянувшись в линию. На краях нуклеотидов находится слишком много положительно и отрицательно заряженных частей, которые легко образуют водородные связи друг с другом. Про то, как такие же связи образуются между нуклеотидами двух молекул ДНК, соединяя их в двойную спираль, рассказано в главе 10, а за подробностями о водородных связях можно залезть в главу 15. Водородные связи менее прочны, чем связи между атомами в молекулах, но их достаточно для того, чтобы причудливо скрутить нить тРНК и держать ее в таком положении. Сначала эти связи образуются только между некоторыми нуклеотидами, сворачивая тРНК в фигуру наподобие листа клевера. Результат этого начального свертывания называют вторичной структурой тРНК. На схеме слева видно, что только некоторые нуклеотиды связываются водородными связями, а другие остаются неспаренными, образуя кольца и петли. Различия между вторичной структурой разных видов тРНК обусловлены различиями в их первичной структуре. Проявляется это в разной длине «клеверных листов» или «стебелька» за счет разной длины исходной цепочки нуклеотидов.
Другим отличием первичной структуры разных тРНК является то, что только в некоторых позициях у них стоят одни и те же нуклеотиды (на схеме вверху они отмечены первыми буквами своих названий), большинство же нуклеотидов у разных тРНК отличаются друг от друга. Приведенная выше схема является общей для всех тРНК, поэтому отличающиеся нуклеотиды отмечены числами.
Главными функциональными частями тРНК являются:
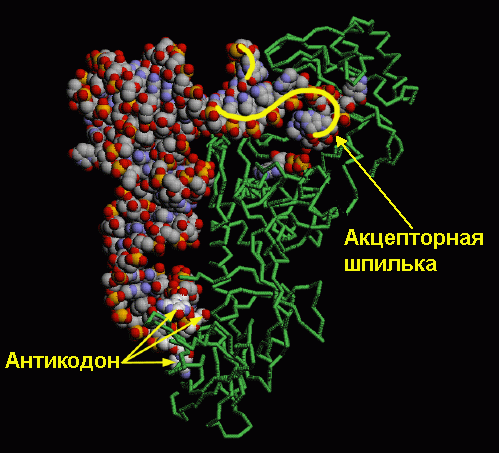
=) антикодон, то есть последовательность нуклеотидов, комплементарная единственному кодону матричной РНК, находящаяся на антикодоновой шпильке
=) акцепторный конец, к которому может быть присоединена аминокислота. Он находится с противоположной стороны от антикодоновой шпильки.
В реальности ни одна тРНК не выглядит так, как на схеме вторичной структуры, потому что для ее образования соединились между собой только некоторые нуклеотиды, а остальные остались неспаренными. За счет образования водородных связей между нуклеотидами из разных частей листа клевера он сворачивается дальше в гораздо более сложную третичную структуру в форме буквы L. Ты можешь понять, как именно изогнулись разные части вторичной структуры для образования третичной, сопоставив цвета на их схемах ниже. Антикодоновая шпилька, обозначенная голубым и серым цветами, остается внизу (стоит помнить, что это «внизу» является условным: удобно изображать тРНК именно в такой пространственной ориентации в схемах трансляции белка), а акцепторный конец (желтого цвета) загнут в сторону.
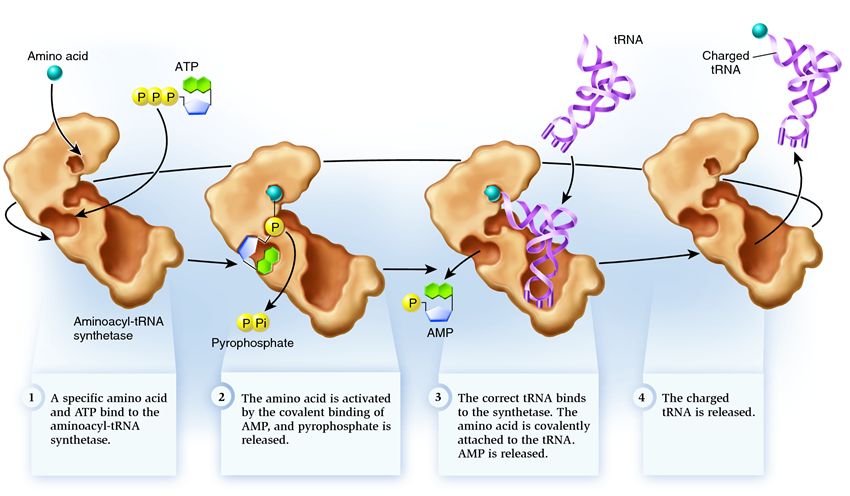
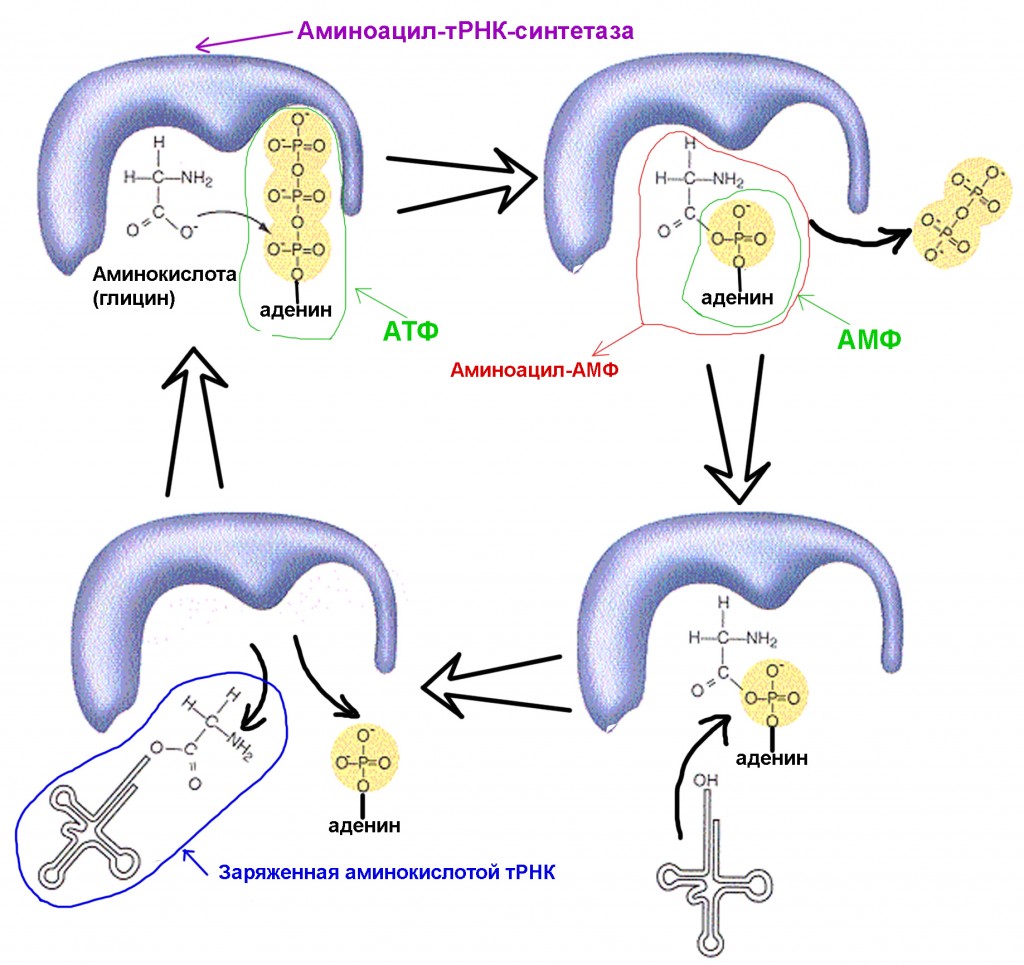
Именно так выглядит тРНК, готовая к присоединению аминокислоты. Самостоятельно соединиться с аминокислотой тРНК не способна, для этого требуется участие специального фермента: аминоацил-тРНК-синтетазы. Число видов синтетаз в клетке совпадает с числом видов тРНК.
Единообразие формы всех видов тРНК необходимо для того, чтобы рибосома могла распознавать любую из них, способствовать их стыковке с мРНК, перемещать внутри себя из одного сайта в другой. Если бы разные виды тРНК существенно отличались друг от друга, это чрезвычайно затруднило бы работу рибосомы, критически снизив скорость синтеза протеина. Естественный отбор таким образом направлен на то, чтобы сделать тРНК похожими друг на друга. Но вместе с тем есть и другой фактор, требующий существования заметных различий между разными видами тРНК: ведь необходимо распознать каждый вид и прикрепить к нему единственную, соответствующую ему аминокислоту. Очевидно, что эти отличия должны быть хоть и заметными, но не слишком существенными, так что работа по распознаванию видов тРНК превращается в ювелирный процесс. И именно его осуществляют аминоацил-тРНК-синтетазы: каждая из них может связаться только с одной из 20 аминокислот и присоединить ее именно к тем видам тРНК, которые этой аминокислоте соответствуют. Из таблицы с генетическим кодом видно, что каждая аминокислота кодируется несколькими последовательностями нуклеотидов, поэтому например все четыре тРНК с антикодонами CGA, CGG, CGU и CGC будут распознаваться одной и той же синтетазой, присоединяющей к ним аланин. Такие обрабатываемые одной синтетазой тРНК называются родственными.
Синтетаза принадлежит к группе ферментов, чья функция заключается в связывании с отдельно существующими молекулами и объединении их в одну:
1. синтетаза соединяет аминокислоту и молекулу АТФ. От АТФ отрываются две фосфатные группы, высвобождая энергию, необходимую для следующих действий. Остающийся от разрушенной молекулы аденозинмонофосфат (АМФ) присоединяется к аминокислоте, подготовив ее к соединению с акцепторной шпилькой.
2. синтетаза присоединяет к себе одну из соответствующих этой аминокислоте родственных тРНК.
На этом этапе происходит проверка соответствия транспортной РНК синтетазе. Существует несколько способов распознавания, и в каждой синтетазе имеется уникальная их комбинация. Во взаимодействии синтетазы и тРНК участвует как минимум один нуклеотид антикодона. Так же требует проверки акцепторная шпилька: определяется наличие на ней специфических нуклеотидов, общих для соответствующих нужной аминокислоте родственных тРНК. Нуклеотиды других частей тРНК тоже могут участвовать в проверке соответствия, соединяясь с определенными местами синтетазы. Неправильная тРНК может совпадать с нужной по каким-то параметрам, но из-за неполного совпадения будет присоединяться к синтетазе медленно и неплотно, легко отваливаясь. А правильная тРНК прилипнет к синтетазе быстро и крепко, в результате чего структура синтетазы меняется, запуская процесс аминоацилирования, то есть присоединения аминокислоты к тРНК.
3. аминоацилирование заключается в замене присоединенной к аминокислоте молекулы АМФ на молекулу тРНК. После этой замены АМФ покидает синтетазу, а тРНК задерживается для последней проверки аминокислоты. Если присоединенная аминокислота опознается как неправильная, она будет отсоединена от тРНК, место аминокислоты в синтетазе опустеет, и туда сможет присоединиться другая молекула. Новая аминокислота пройдет стадии соединения с АТФ и тРНК, и тоже подвергнется проверке. Если же ошибок допущено не было, заряженная аминокислотой тРНК освобождается: она готова сыграть свою роль в трансляции протеина. А синтетаза готова присоединить новые аминокислоту и тРНК, и цикл начнется заново.
От правильности работы аминоацил-тРНК-синтетазы зависит многое: если на этом этапе произойдет сбой, то к тРНК будет присоединена неверная аминокислота. И она будет встроена в растущий на рибосоме протеин, ведь тРНК и рибосома не имеют функции проверки соответствия кодона и аминокислоты. Последствия ошибки могут быть незначительными или катастрофическими, и в ходе естественного отбора существа с ферментами, не имеющими функции таких проверок, были вытеснены более приспособленными, имеющими различные варианты установления соответствия между аминокислотой и тРНК. Поэтому в современных клетках синтетаза соединяется с неверной аминокислотой в среднем в одном случае из 50 тысяч, а с ошибочной тРНК всего лишь один раз на 100 тысяч присоединений.
Некоторые аминокислоты отличаются друг от друга всего лишь несколькими атомами. Если взглянуть на их схемы, становится очевидно, что вероятность перепутать аргинин с аланином гораздо меньше, чем принять изолейцин за лейцин или валин. Поэтому у каждой синтетазы, связывающейся с одной из похожих друг на друга аминокислот, имеются дополнительные механизмы проверки. Вот пример такого приспособления у изолейцин-тРНК-синтетазы:
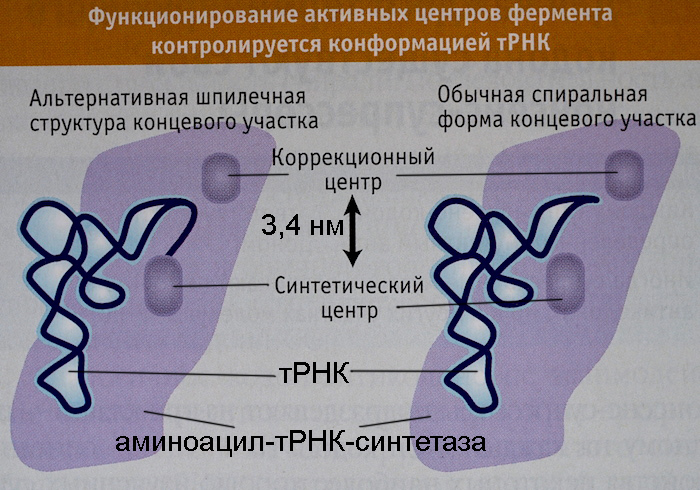
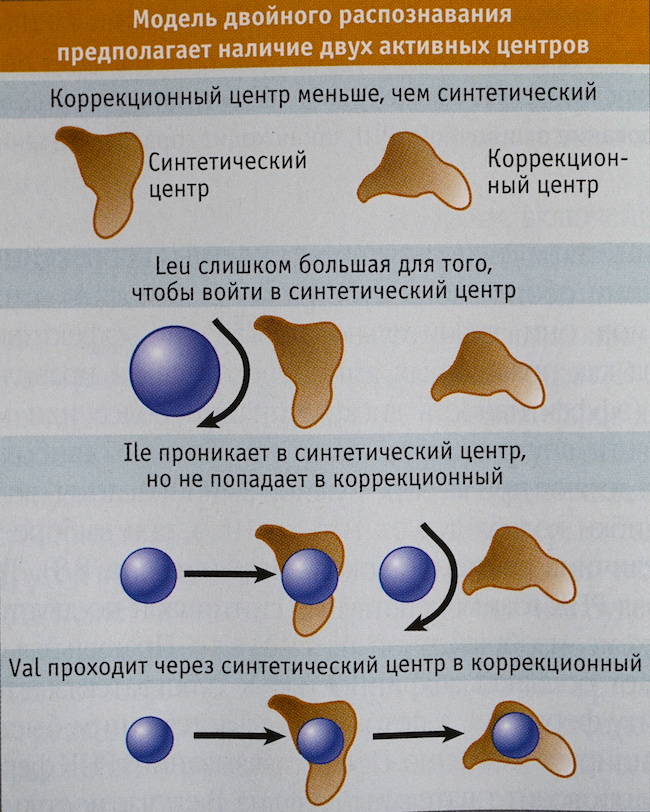
У каждой синтетазы существует синтетический центр, в котором происходит присоединение аминокислоты к тРНК. Акцепторная шпилька тРНК, захваченной синтетазой, попадает именно туда, так же как и аминокислота, готовая вступить в реакцию с ней. Работа некоторых синтетаз заканчивается сразу после соединения аминокислоты и тРНК. Но Ile-тРНК-синтетаза имеет повышенную вероятность совершения ошибок из-за существования других похожих на изолейцин аминокислот. Поэтому у нее есть еще и коррекционный центр: из названия понятно, какую роль он играет в процессе соединения тРНК и аминокислоты. На рисунке справа видно, что положение конца акцепторной шпильки тРНК в синтетическом центре Ile-тРНК-синтетазы придает этой шпильке неестественный изгиб. Тем не менее, синтетаза удерживает тРНК в таком положении до момента присоединения к ней аминокислоты. После того, как это соединение произошло, необходимость нахождения акцепторной шпильки в синтетическом центре исчерпана, и тРНК распрямляется, попадая своим концом с насаженной на него аминокислотой в коррекционный центр.
Конечно же, синтетический центр тоже играет свою роль в отсеивании не подходящих синтетазе аминокислот. Чтобы попасть в него, молекуле необходимо отвечать ряду условий, в том числе иметь подходящий размер. Несмотря на то, что лейцин и изолейцин содержат одно и то же количество атомов, из-за различий в пространственной структуре лейцин крупнее. Поэтому он не может проникнуть в синтетический центр, размеры которого соответствуют более компактному изолейцину, и просто отскакивает от Ile-тРНК-синтетазы.
Но вот валин, являющийся самой мелкой из этих трех молекул со схожей атомной структурой, легко занимает место изолейцина в синтетическом центре, и синтетаза присоединяет его к тРНК. Именно в этом случае вступает в игру коррекционный центр синтетазы. Если распрямляющаяся акцепторная шпилька заряжена верно и несет изолейцин, то она не может протиснуться внутрь коррекционного центра: он просто слишком мал для этой молекулы. Таким образом, распрямившуюся тРНК больше ничто не держит, и она отсоединяется от синтетазы. А вот если к тРНК присоединен валин, он проскальзывает в коррекционный центр, тем самым удерживая соединенную с ним тРНК в синтетазе. Такое излишне длительное нахождение тРНК внутри является для синтетазы сигналом ошибки, меняя ее пространственную конфигурацию. В результате этого:
=) валин отсоединяется от тРНК и удаляется из синтетазы
=) акцепторная шпилька возвращается в синтетический центр, ожидая присоединения к аминокислоте
=) синтетаза связывается с новой аминокислотой, «заряжает» ей тРНК и снова проверяет, был ли использован для этого именно изолейцин.
Схожий механизм двойного распознавания используется и другими синтетазами.