Общее представление о трансляции, то есть сборке протеина по чертежу матричной РНК, было дано раньше, в главе 16. Центральной фигурой в этом сложном процессе является рибосома. Именно она является прорабом, ответственным за создание сложных протеиновых конструкций. Она собирает в одном месте всех участников, необходимых для совершения процесса трансляции: матричную РНК (мРНК), которая является чертежом для построения протеина, а также транспортные РНК (тРНК), каждая из которых несет с собой строительный материал в виде конкретной аминокислоты.
Механизм создания протеинов, который будет описан ниже, настолько древний, что даже в клетках млекопитающих и прокариот, эволюционно максимально удаленных друг от друга, он практически идентичен. Различия есть, конечно, но очевидно, что они эволюционировали от единственного набора органелл и молекул, позволившего в далеком Катархее выжить и размножиться некой клетке-«прародительнице». В ходе эволюции живых организмов общий план строения рибосомы почти не менялся. Тем не менее рибосомы бактерий, рибосомы цитоплазмы эукариот и рибосомы органелл имеют множество различий: по размеру, молекулярному составу и т.п. Некоторые из органелл клетки имеют свои собственные рибосомы, чтобы осуществлять синтез протеинов внутри себя и не утруждаться протаскиванием их снаружи через свою шкуру-мембрану.
Рибосома бактерий немного меньше и проще устроена, чем рибосома эукариот, но в целом они очень похожи. Поэтому если речь идет о рибосоме без уточнения, какая из них имеется в виду, значит данный факт подходит к обеим. Если описание будет касаться только одной из них, то будет пояснение, к чему оно относится. Рибосомы органелл могут быть нескольких видов, и различия между ними и клеточными рибосомами более существенные, поэтому речь о них пойдет в посвященных этим органеллам главах.
На этой картинке показаны сравнительные размеры рибосомы (большая желтая штука), тРНК (две запутанные изогнутые синие молекулы) и участка мРНК, состоящего из 35 нуклеотидов. Для наглядности можно вспомнить, что диаметр орбиты электрона в невозбуждённом атоме водорода равен 0,1 нанометра, так что можно оценить, насколько малы изображенные здесь рибосома и молекулы. Например, высота тРНК равна длине цепочки всего лишь из 60 атомов водорода.
Рибосомы очень малы и погружены во внутриклеточную жидкость, поэтому важной их характеристикой является скорость их осаждения (то есть выпадения в осадок). Представь себе две молекулы, составленные из одинакового набора атомов, но скомпонованы они по-разному: одна имеет форму компактного шара, а другая — широкой пластины. Очевидно, что раз площадь их поверхности настолько отличается, то и их движение сквозь жидкость будет отличаться: шар будет перемещаться быстрее, чем пластина, так как сила сопротивления окружающей среды для шара будет намного меньше. С другой стороны, если две молекулы имеют одинаковый размер площади сечения, но разную массу, то более тяжелая молекула будет выпадать в осадок быстрее, так как она имеет большую инерцию, и частицы окружающей среды будут оказывать на нее меньшее воздействие. Таким образом, скорость осаждения молекул и частиц дает представление об их пространственной протяженности и об их массе. В зависимости от быстроты осаждения частицам присваивается коэффициент седиментации ( sedimentation coefficient [sedɪmen’teɪʃn kəu’fɪʃnt] ): чем быстрее осаждаются частицы, тем этот коэффициент выше. Для совершенно одинаковых молекул этот коэффициент будет одним и тем же, поэтому например каждая рибосома эукариот имеет коэффициент седиментации, равный 80S, и ее принято обозначать как 80S-частицу. Это гораздо удобнее, чем каждый раз писать «рибосома эукариотической клетки». Бактериальная рибосома имеет коэффициент седиментации 70S и обозначается как 70S-частица, что указывает на меньшую скорость осаждения.
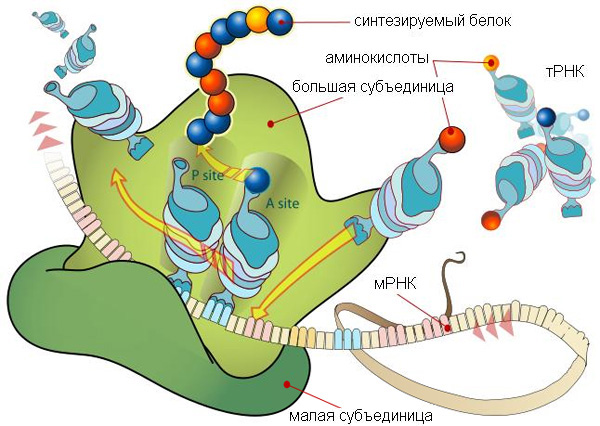
На картинке вверху рибосома изображена очень схематично, так что заметно только разделение ее на две субъединицы ( subunit [‘sʌbjuːnɪt] ): большую и малую. Справа ты видишь гораздо более подробную схему эукариотической рибосомы. Несмотря на то, что на первый взгляд это выглядит как спутанная разноцветная мочалка ( loofah [‘luːfə] ), она демонстрирует как разделение рибосомы на 2 субъединицы, так и молекулярный состав этих частей.
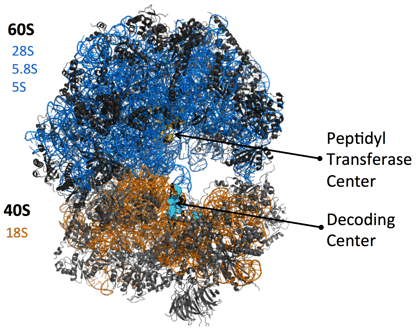
Основу каждой субъединицы составляют молекулы РНК: малой субъединице хватает одной рРНК (рибосомальной РНК), а в большой их 3. У бактериальной рибосомы, меньшей по размеру, большая субъединица обходится только двумя рРНК. Рибосомальные РНК большой субъединицы здесь обозначены синим цветом, а рРНК малой субъединицы — оранжевым. Для каждой из молекул подписан коэффициент седиментации, цвет подписи соответствует цвету молекулы на картинке. Например, три рибосомальных РНК большой субъединицы имеют коэффициенты 28S, 5,8S и 5S. По этим цифрам понятно, что в большой субъединице одна рРНК значительно крупнее двух других.
Остальные молекулы в составе эукариотической рибосомы являются небольшими протеинами. На схеме они обозначены черными спиралями. Заметно, что из РНК состоит больше половины «тела» рибосомы. Они образуют ее каркас, в который встраиваются протеины. С помощью различных опытов было установлено, что рРНК и протеины работают слаженно, и каждое движение рибосомы, каждый инициированный ею процесс требует участия обоих видов молекул.
На этой схеме указано, что большая субъединица имеет коэффициент седиментации, равный 60S, а малая — 40S. Получается, что коэффициент седиментации полной рибосомы (80S) меньше, чем сумма коэффициентов двух ее субъединиц. Причина этого в том, что получающаяся при соединении субъединиц рибосома более протяженна в пространстве, чем это было бы, если бы эти субъединицы просто были бы вложены друг в друга так, чтобы занимаемый ими объем не увеличился. То есть, когда мы складываем две отдельные субъединицы вместе, то их совокупная масса конечно равняется сумме их отдельных масс, но и площадь сечения тоже увеличивается. Чтобы это было яснее, рассмотрим простой пример. Допустим, что мы сделали что-то с рибосомой, не добавляя никаких атомов к ней и не отнимая от нее никакие атомы, после чего измерили её коэффициент седиментации и обнаружили, что он теперь равняется не 80S, а 70S. Что бы нам это сказало? Так как коэффициент уменьшился, значит скорость осаждения уменьшилась, а значит сопротивление среды выросло. Значит в результате нашего воздействия рибосома стала менее компактной, площадь ее сечения выросла.
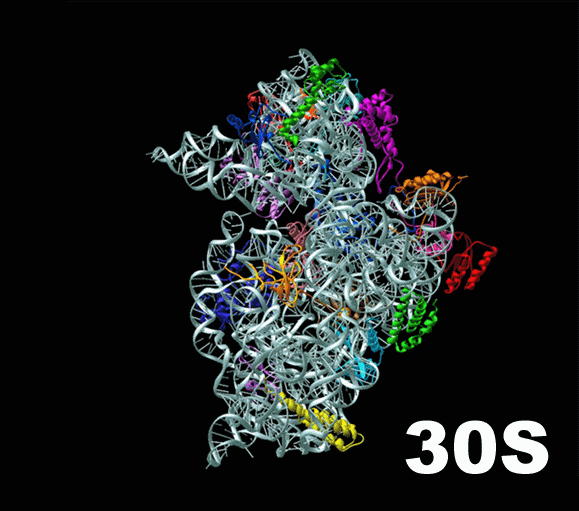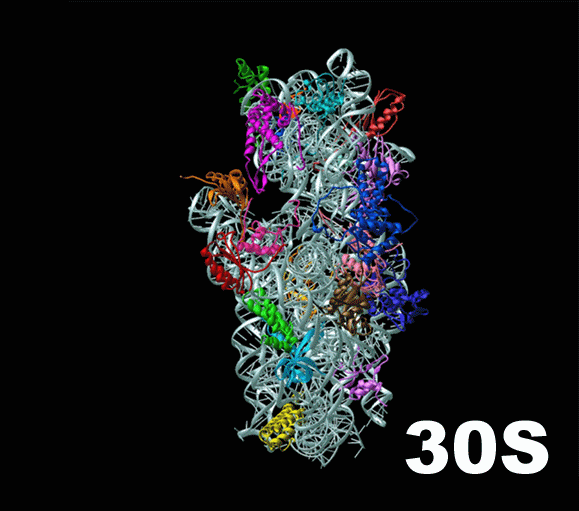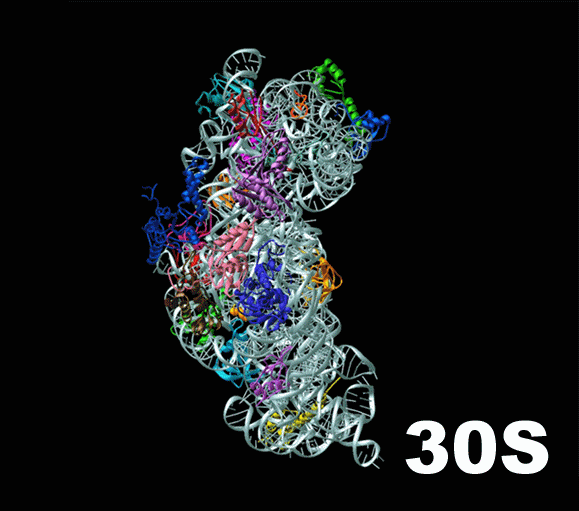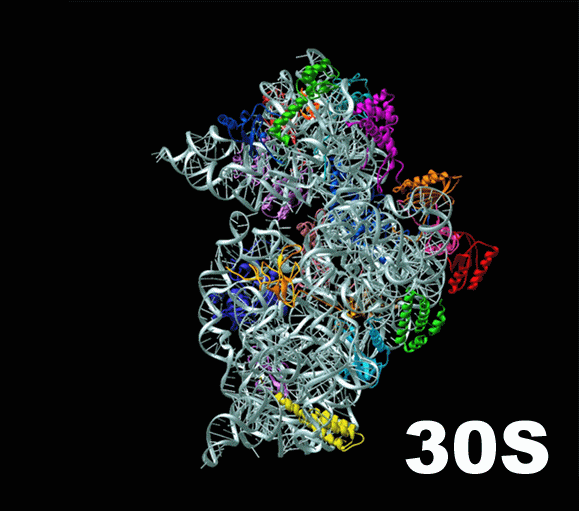
Слева — схема 30S-частицы, или малой субъединицы ( small subunit [smɔːl ‘sʌbjuːnɪt] ) бактериальной рибосомы. Ее коэффициент седиментации немного меньше, чем у малой субъединицы эукариотической рибосомы. При этом их функция одинакова: они служат каркасом, на котором молекулы тРНК, каждая из которых несет какую-то определенную аминокислоту, могут быть точно сопоставлены с кодонами мРНК. Малая субъединица не просто предоставляет тРНК и мРНК «место для встречи», но и располагает мРНК удобным образом, и придерживает нижнюю часть тРНК, содержащую антикодон, для лучшего закрепления ее на соответствующем ей кодоне мРНК.
Таким образом, только рибосома создает такие условия, при которых возможно присоединение нижнего конца тРНК к кодонам, составляющим мРНК, и в этом есть огромный смысл: если бы тРНК и мРНК могли соединяться запросто, без создания им таких комфортных условий, то в клетке наступил бы полный хаос: не успеет только что построенная мРНК осмотреться, найти свою рибосому, как со всех сторон ее уже облепили бы тРНК и просто висели бы на ней, потому что сами они протеин из принесенных аминокислот построить не в состоянии. Для этого им нужна большая субъединица.
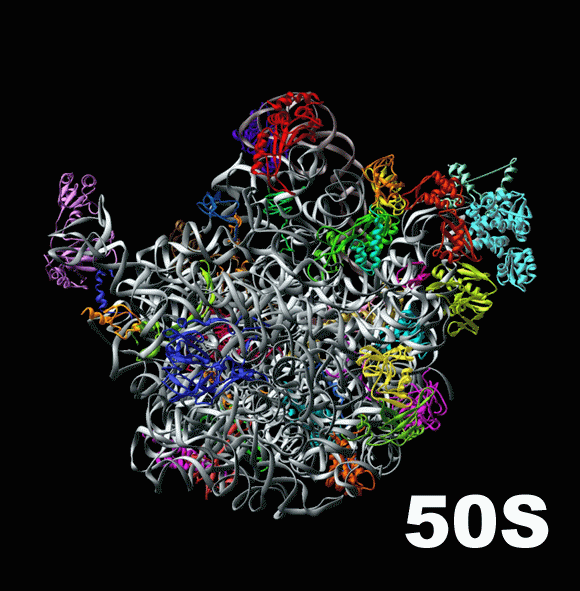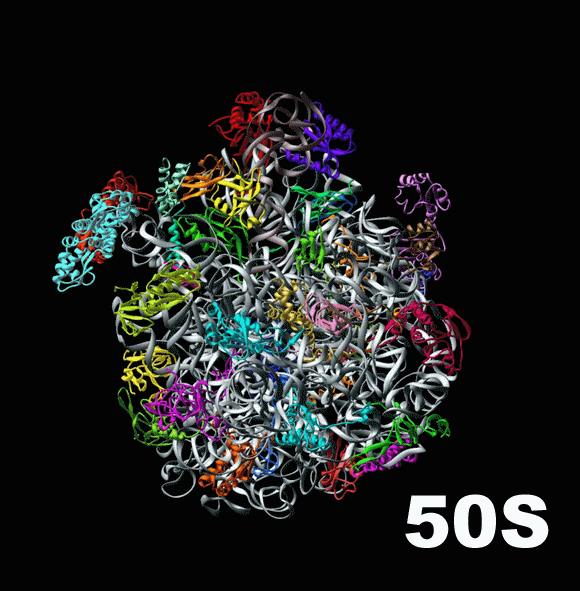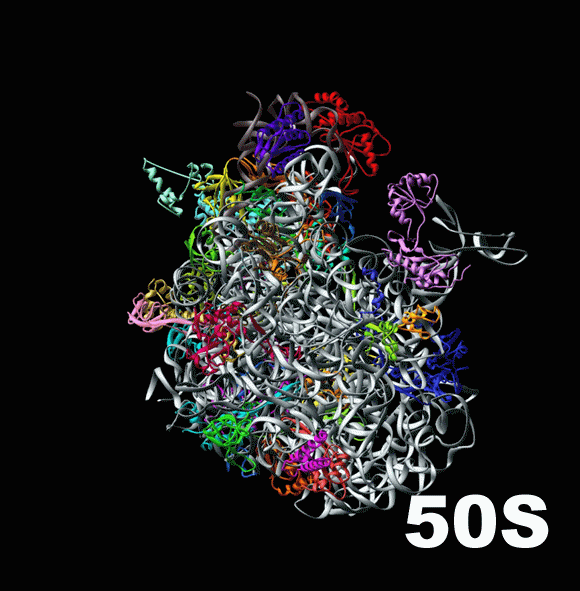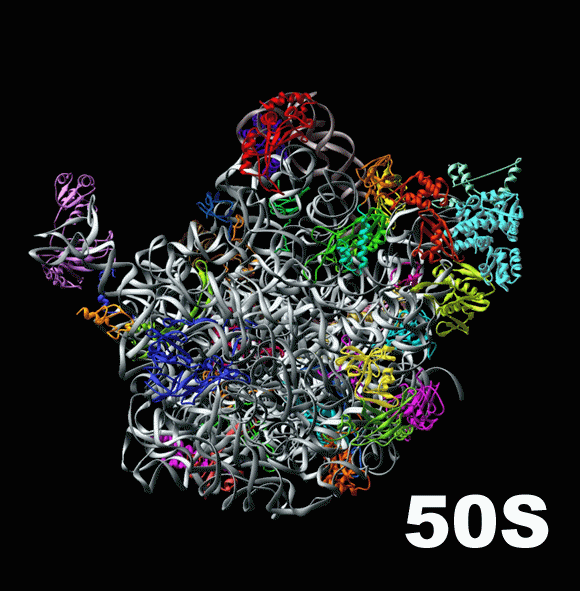
В то время как малая субъединица контактирует с нижними концами тРНК, удерживая их внутри рибосомы и сопоставляя с мРНК, большая субъединица занимается их верхними концами, на которых тРНК несут аминокислоты. Деление на «нижний» и «верхний» концы транспортной рибосомы конечно же условно: просто именно так их принято изображать на схемах трансляции. Большая субъединица создает для тРНК полости внутри себя, так называемые «сайты связывания», и работает с аминокислотами. Недостаточно просто поднести две аминокислоты друг к другу, чтобы они соединились: необходимо отсоединить их от тРНК и придать им некий «импульс», потратить энергию для создания между аминокислотами специальной, так называемой «пептидной связи» ( peptide bond [‘pɛptʌɪd bɔnd] ). Именно сопоставлением аминокислот и сообщением им необходимой для соединения энергии и занимается большая субъединица. Здесь показана большая субъединица бактериальной рибосомы, или 50S-частица.
Очевидно, что рибосома как-то развивалась, эволюционировала до появления таких сложнозакрученных молекул, ювелирно перемещающих внутри себя транспортные и матричную РНК. Эволюционный путь, пройденный животными и растениями, можно восстановить по частям их ископаемых предков, но пока не найдены гигантские окаменелые рибосомы, приходится искать другие пути. Канадские биохимики Константин Боков и Сергей Штейнберг нашли способ узнать, как могла сформироваться настолько сложная органелла клетки. Исследование заключалось в последовательном выполнении следующих действий:
1. отделить мелкую часть рибосомы (один из протеинов, или часть рибосомальной РНК)
2. оценить изменения в пространственной структуре рибосомы, оставшейся без этой части. Если оставшиеся молекулы продолжали держаться вместе, если конфигурация их оставалась такой же, как в полной рибосоме, то выдвигалась гипотеза, что именно такой состав молекул имел более древний вариант рибосомы до того, как она эволюционировала, отрастив у себя как раз ту мелкую часть, которая была удалена в процессе опыта.
3. изучить, какую функцию, или часть функции, рибосома утратила вместе с удаленной частью. Вполне вероятно, что именно для реализации этой функции эта часть и была присоединена когда-то.
4. изучить функционирование оставшихся молекул рибосомы, понять — что она может делать, могла ли древняя клетка использовать такую рибосому для поддержания своей жизнедеятельности.
5. после проделывания всех этих процедур можно откинуться в кресле с бутером в зубах, ну а потом продолжить: отделить следующую часть рибосомы, оценить пространственную структуру остатка, посмотреть, на что этот остаток будет способен…
Повторяя эти действия, ученые шаг за шагом «раздевали» рибосому, удалив 93% составляющих ее молекул. И в итоге добрались до той ее части, с которой предположительно и началось существование этих синтезирующих протеины органелл: дальнейшее удаление частей молекул приводило к тому, что остаток просто разваливался на нефункциональные части. Эта часть в современной рибосоме отвечает за создание связи между аминокислотами, когда новая аминокислота присоединяется к строящемуся протеину.
Оставшиеся 7% рибосомы представляют собой РНК длиной в 110 нуклеотидов, которая имеет сайт для присоединения одной транспортной РНК. Если этот фрагмент удвоить, он может опознавать и удерживать уже не одну, а две тРНК. И не просто удерживать, а переносить аминокислоту с одной тРНК на другую, так что этот двойной фрагмент является самой простой, но уже функционально активной проторибосомой, которая может синтезировать протеины. То, что она именно функционально активна, подтвердил эксперимент: созданный учеными удвоенный минимальный остаток рибосомы был способен проводить реакцию присоединения одной аминокислоты к другой.
Той части, которой современная рибосома удерживает матричную РНК, в проторибосоме нет. Поэтому последовательность аминокислот в первичной молекуле протеина на том этапе ничем не задавалась, она была случайной. Постепенно проторибосома обрастала новыми и новыми элементами, и чтобы понять, в какой последовательности это происходило, какие свойства приносила каждая новая часть, достаточно «промотать в обратном направлении» результаты разбиения рисобомы на части. Первые восемь элементов, присоединенные к проторибосоме, придали ей дополнительную устойчивость. Следующие 12 элементов увеличили массу. На ранних стадиях рибосомы существовали как тела, построенные исключительно из РНК, но когда они «наработали» какое-то количество протеинов, то стали использовать их для усложнения своей структуры, приобретения новых функций. Когда все элементы были собраны воедино, сформировались две субъединицы рибосомы, состоящих как из РНК, так и из протеинов — именно в том виде, в котором мы можем их наблюдать в современных клетках. «Наши результаты продемонстрировали, — пишет Сергей Штейнберг, — что такая сложная структура, как рибосома, могла самостоятельно построиться из простых молекул, которые взаимодействовали между собой по очень простым химическим правилам. Это могло произойти в эволюции за относительно короткое время».
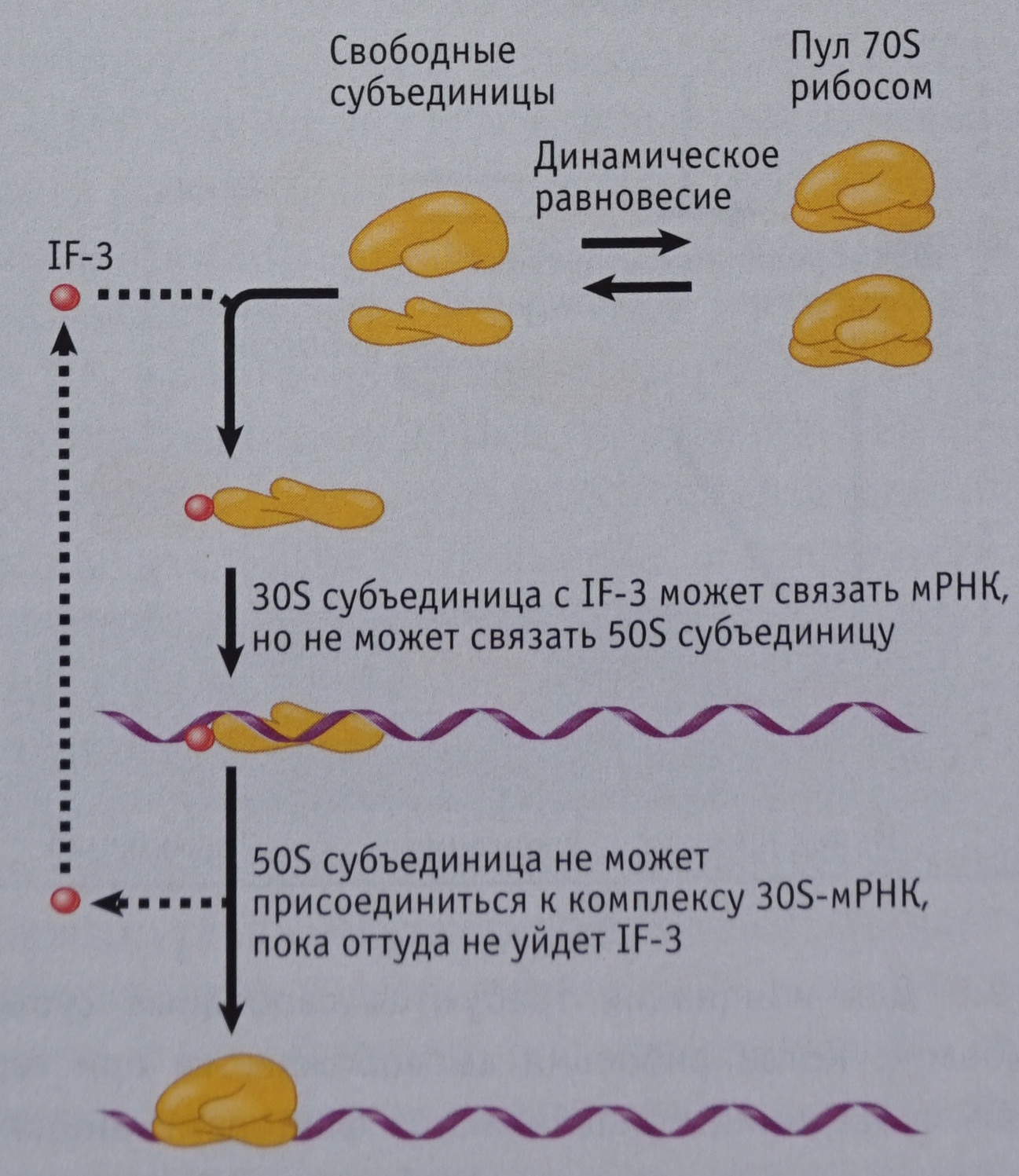
Есть существенное отличие рибосомы от других органелл клетки: она существует в том виде, который здесь описан, только во время выполнения своей функции синтеза протеина. Все остальное время отдыхающая рибосома находится в клетке в разобранном состоянии: большая и малая субъединица плавают отдельно друг от друга, и только после обнаружения малой субъединицей готовой к трансляции мРНК большая субъединица присоединяется к ней. Субъединицы неразлучны во время синтеза протеина, но как только он завершен, они разъединяются и расплываются в разные стороны. У бактериальных и эукариотических рибосом соединение субъединиц и начало трансляции протекает по-разному. Процесс начала, или инициации ( initiation [ɪnɪʃɪ’eɪʃn] ), синтеза протеина бактериальной рибосомой немного проще, поэтому стоит начать с него. Все, что написано ниже, касается именно бактериальной рибосомы:
1. Пока малая субъединица плавает в одиночестве, к ней не могут присоединиться ни матричная РНК, ни большая субъединица. Процесс трансляции начинается с того, что малая субъединица сталкивается с молекулами протеинов, которые называют факторами инициации ( initiating factor [ɪnɪʃɪ’eɪʃn ‘fæktə] ). Именно эти протеины запускают цепочку процессов, необходимых для старта трансляции. Факторов инициации у бактериальной рибосомы найдено только 3, их так и обозначают: IF-1, IF-2 и IF-3. Каждый из них имеет определенное место на малой субъединице, к которому может присоединиться. Для начала синтеза протеина необходимо, чтобы все 3 фактора инициации выполнили свою функцию.
Первым из них «садится» на малую субъединицу IF-3, и в результате его присутствия к ней может присоединиться мРНК. Только IF-3 может присоединиться к свободно плавающей малой субъединице. Только после этого присоединения другие частицы могут начать присоединяться к полученному комплексу.
2. К комплексу «малая субъединица + IF-3» может присоединиться мРНК. А вот большая субъединица все еще не может вступить в процесс, так как не все условия для ее присоединения на данном этапе присутствуют.
3. К комплексу «малая субъединица + IF-3 + мРНК» присоединяются еще два фактора инициации: IF-1 и IF-2, при этом последний несет с собой особую транспортную РНК, которую называют инициаторной РНК ( initiation RNA [ɪnɪʃɪ’eɪʃn ɑ:r en eɪ] ). Про нее речь пойдет в следующей главе генетической линии учебника, а пока достаточно знать, что только инициаторная тРНК может быть связана с IF-2 и начать трансляцию. Любая другая тРНК просто не способна взаимодействовать с IF-2.
Малая субъединица уже начала выполнять свою функцию придерживания мРНК для удобства вставания на нее тРНК. Она подставляет для считывания два кодона, и на первом из них протеин IF-2 закрепляет инициаторную тРНК. Присоединение любой тРНК на второй открытый кодон сейчас нежелательно (причина этого будет объяснена позже), поэтому требуется его закрыть на время. Для этого и используется протеин IF-1, садящийся на этот кодон, перекрывая к нему доступ. Очень простое и эффективное решение.
4. Как только малая субъединица, мРНК и инициаторная тРНК прочно сцепились, IF-3 проверяет: является ли присоединенная тРНК инициаторной и присоединилась ли она в нужном месте мРНК. Такие дополнительные проверки часто встречаются при синтезе протеинов. Первый раз IF-3 проверил, что эта тРНК является именно инициаторной, в момент соединения с ней, но тогда могла произойти ошибка, которая и будет исправлена во время второй проверки.
Если результат проверки положительный, все три фактора инициации уходят, и только тогда большая субъединица может соединиться с малой, «накрывая» собой инициаторную тРНК и мРНК. Очевидно, что здесь требуется большая точность стыковки: большая субъединица должна «приземлиться» так, чтоб инициаторная тРНК проскользнула внутрь, встав в один из сайтов внутри собравшейся рибосомы. Если бы IF-1 не блокировал второй открытый для считывания кодон и на него бы села вторая тРНК, большая субъединица испытывала бы сложности с присоединением. Ведь ей пришлось бы изворачиваться так, чтобы в нужные места внутри рибосомы встали уже две тРНК. Чем сложнее действие, тем больше вероятность промедлений и ошибок, поэтому в процессе эволюции и возник IF-1, блокирующий один из кодонов мРНК и таким образом упрощающий процесс присоединения большой субъединицы.
Такое соединение субъединиц бактериальной рибосомы может осуществляться только на одном участке мРНК, который называют сайтом связывания ( binding site [‘baɪndɪŋ saɪt] ) рибосомы. Он находится непосредственно перед участком, кодирующим протеин. В одной из следующих глав будет подробно рассмотрено строение матричной РНК, а пока просто прими как факт, что кроме кодирующих участков на ней есть еще и «служебные», подающие разные сигналы таким участникам трансляции, как вспомогательные факторы и рибосома.
На этом инициация трансляции завершена, рибосома собрана, спокойна и готова к работе.