Часть 1 — вводная:
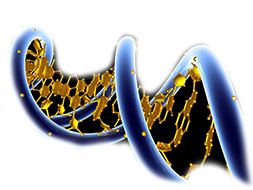
На рисунке — общий вид протеасомы ( proteasome [‘prətɪəsəʊm] ). Протеасома — это сложный протеиновый комплекс, присутствующий во всех эукариотах, археях и некоторых бактериях. Главная функция протеасомы — расщеплять ненужные или поврежденные протеины с помощью реакций протеолиза ( proteolysis [prətɪ’ɒlɪsɪs] ). Протеолиз — это химическая реакция, которая разрушает пептидные связи ( peptide bonds [‘pɛptʌɪd bɔnds] ) между аминокислотами, из которых и состоит каждый протеин. Осуществлением протеолиза занимаются специальные ферменты — протеазы ( protease [‘prəʊtɪeɪz] ), которые входят в состав протеосомы.
Протеасомы у эукариот находятся как в ядре клетки, так и в цитоплазме.
Составная часть протеасомы, обозначенная синим цветом, имеет обозначение 20S и представляет собой трубу, внутри которой и происходит протеолиз ненужных белков. Составная часть протеасомы, обозначенная красным цветом (как видно, их две), обозначается 19S и играет две основные роли: будучи своего рода «крышкой», она предотвращает случайное попадание внутрь трубы полезных белки, и кроме того к этой «крышке» цепляются белки перед тем, как отправиться внутрь трубы для последующей их деградации.
В каждой клетке существует большое количество очень мелких белков, которые называются «убиквитин» ( ubiquitin [juː’bɪkwɪtɪn] ). Подлежащие уничтожению протеины с помощью работы специально предназначенного для этого протеинового комплекса помечаются хвостом, состоящим из нескольких молекул именно этого убиквитина. Протеиновый комплекс, связывающий жертву с убиквитином, называется «убиквитинлигаза» (ubiquitin ligase [juː’bɪkwɪtɪn ‘lɪgeɪz] or E3 ubiquitin ligase). Он присоединяет к жертве одну за другой молекулы убиквитина, пока их не станет минимум 4 штуки. После этого еще один специальный протеин хватает помеченную убиквитиновым хвостом объект и тащит его к протеасоме, прикрепляя его к крышке. Этот протеин-переносчик реагирует только на те протеины, у которых длина убиквитинового хвоста не меньше четырех молекул, и в этом есть важный смысл, ведь если бы он реагировал на хвост, состоящий из одного или двух убиквитинов, то в итоге он бы тащил на переработку много лишнего и нужного, включая убиквитинлигазу!
После того, как жертва, помеченная убитиновым хвостом, притаскивается к протеасоме, её «крышка» открывается, ненужный протеин разворачивается и его засасывает в узкое горлышко трубы (шириной примерно 15 ангстрем), после чего он попадает во внутреннее пространство трубы (шириной в 50 ангстрем), где и разрезается на мелкие фрагменты (обычно длиной 7-9 аминокислот), после чего получившиеся короткие цепочки аминокислот выбрасываются через противоположное отверстие и разрезаются другими протеиновыми комплексами на одиночные аминокислоты, которые затем используются клеткой для построения нужных ей белков. Иногда бывает и так, что получившиеся в результате работы протеасомы короткие цепочки аминокислот нужны клетке для тех или иных целей, и тогда они не разрезаются дальше, а используются в таком виде.
В целом вся эта система навешивания убиквитина и последующего расщепления белков внутри протеасомы называется «убиквитин-протеасомной системой” (ubiquitin-proteasome system — UPS).
Часть 2:
Способность протеасомы расщеплять длинные цепочки аминокислот используется иногда и довольно необычным образом. Некоторые протеины изготавливаются в неактивной форме, и в таком неактивном виде находятся внутри клетки. Если в них возникает срочная потребность, то нет нужны сначала синтезировать их с ДНК, ведь они уже готовы, и их надо только активизировать. Для этого они убиквитинируются и переносятся к протеасоме, но устроены они таким образом, что механизм разворачивания свернутого белка в цепочку сработать не может (обычно это достигается специальными вставками, состоящих из многократно повторенных чередующихся глицина и аланина). И в результате внутрь протеасомы может всунуться только отросток, содержащий на себе дезактивирующий хвост. Протеасома успешно этот хвост отрезает, после чего исходный белок отваливается от нее уже в полностью работоспособном виде. Такой механизм отрезания части протеина носит название «регулируемая убиквитин-протеасомно-зависимая обработка» (regulated ubiquitin/proteasome dependent processing — RUP).
К сожалению, такой способ избежать деградации протеинов в протеасоме используют и некоторые вирусы. Например, геном вируса Эпштейна-Барр производит некоторые протеины, содержащие в себе эту последовательность чередующихся глицина и аланина, в результате чего эти чужеродные клетке протеины не могут быть уничтожены с помощью протеасомы, и хуже того — они вообще препятствуют нормальной работе протеасомы, что, естественно, влечет за собой негативные последствия для клетки, а вирус при этом может спокойно распространяться дальше. Ведь чтобы Т-лимфоциты начали атаковать вирус, сначала должна состояться процедура, называемая «презентацией антигена» — фактически, Т-лимфоцитам надо показать образчик ДНК, которую нужно атаковать. Для этого с ДНК вируса снимаются антигены, а потом именно протеасомы нарезают эти антигены на искомые образчики. И если протеасома заблокирована, то нарезать антигены на образцы некому, и нечего предъявлять для опознания Т-лимфоцитам, и вирус беспрепятственно развивается.
Когда клетка прекращает выполнять свои функции достаточно хорошо и становится бременем для организма, запускается процесс апоптоза ( apoptosis [æpəp’təusɪs] ) — управляемого её самоуничтожения. Процесс уничтожения органелл клетки во время апоптоза в основном выполняется специальными протеазами, т.е. ферментами, расщепляющими пептидную связь между аминокислотами. Эти протеазы называются «каспазами» (caspase). Каспазы также занимаются уничтожением клеток во время воспалений и некрозов тканей. Кстати говоря, каспазы первоначально производятся именно в неактивной форме, и активируются по мере необходимости другими каспазами — «инициаторными», и делается это опять-таки путем отсечения небольшого участка. Но конечно было бы странно, если бы такие машины, как протеасомы, не участвовали бы в процессе апоптоза. Они и участвуют.
Часть 3: немного подробней о структуре протеасомы.
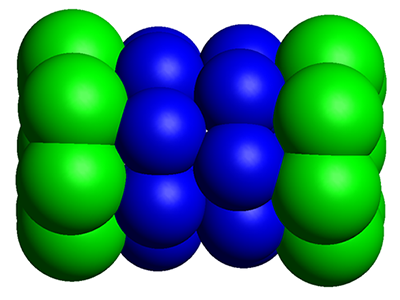
Как мы уже видели на рисунке, протеасома представляет собой цилиндрический комплекс, главное активное ядро которого (20S) выделено на верхнем рисунке синим цветом. Для того, чтобы более ясно представить себе устройство этого ядра протеасомы, посмотрим на его очень упрощенную модель.
Как мы видим, 20S состоит из четырех колец, приставленных друг к другу. Каждое кольцо состоит из 7 протеинов, т.е. является семичленным (heptameric or heptamerous [hɛp’tamərəs] ). Два внутренних кольца состоят из протеинов, которые обозначаются буквой β (β-subunit). Внешние кольца состоят из протеинов, обозначаемых буквой α (α-subunit). Именно β-частицы являются активным элементом протеасомы, так как содержат на своей внутренней поверхности активные зоны — протеазы, которые и расщепляют поступившие в протеасому объекты. Функция α-частиц чисто структурная — они формируют ворота, через которые объекты поступают в активную каталитическую зону. И как уже говорилось, доступ в эти α-ворота контролируется «шапочной структурой» (19S), которая распознает убиквитиновый хвост, присоединенный к протеину, предназначенному для уничтожения. И так как именно β-частицы играют каталитическую роль, т.е. расщепляют протеины, то именно о них и стоит поговорить прежде всего.
И первое, что нужно сказать, это то, что протеасома обрабатывает поступающие внутрь протеины аж тремя видами каталитических реакций — чтоб уж наверняка справиться. Наверное, нет смысла запоминать и тщательно разбираться в том, каковы особенности этих трех реакций, но можно хотя бы просто назвать их, чтобы эти названия как-то осели в пассивной памяти. Первая — химотрипсиновая ( chymotrypsin-like [kʌɪmə‘trɪpsɪn laɪk] ). Вторая — трипсиновая ( trypsin-like [‘trɪpsɪn laɪk] ), и третья — пептидил-глутамил пептидный гидролиз ( peptidyl-glutamyl peptide-hydrolyzing, PGPH ).
Физические размеры 20S довольно велики: 150 ангстрем в длину и 115 в ширину. Диаметр входных ворот примерно равен 15 ангстремам, а диаметр внутреннего пространства — около 50 ангстрем.
В самых простых организмах, таких как некоторые археи (например Thermoplasma acidophilum), все β-частицы одинаковые, и все α-частицы тоже одинаковы. Но в более сложных организмах это уже не так, и в частности все семь β-частиц, составляющих кольцо, отличаются друг от друга. При этом не каждая β-частица является каталитической, т.е. участвует в расщеплении протеинов. У млекопитающих каталитическими являются только частицы β1, β2 и β5. Более того, в кроветворных клетках при особых обстоятельствах (таких как поступление цитокинов, сигнализирующих о воспалительных процессах — например это может быть интерферон-гамма) начинают формироваться протеасомы с β-частицами, немного отличающимися от обычных и обозначаемыми как β1i, β2i и β5i. Протеасомы, собранные в кроветворных клетках из таких видоизмененных β-частиц, называются иммунопротеасомами ( immunoproteasome [ɪm’junɔ’prətɪəsəʊm] ).
В некоторых случаях клетка изготавливает протеасомы с более легкими «шапками» — не 19S, а 11S (напомню, что этот параметр обозначает скорость седиментации, но можно примерно понимать его и так, что чем этот коэффициент больше, тем больше атомов в этом комплексе). 11S точно так же прикрепляется к обоим концам 20S и осуществляет ту же функцию, что и 19S, но такие протеасомы участвуют в основном в деградации чужеродных протеинов — например тех, которые производятся вирусными ДНК. Кроме этого они занимаются деградацией относительно коротких кусков полипептидов — в том числе и тех, на которые обычная протеасома нарезает подлежащие уничтожению протеины.
Каждая «шапка» (т.е. 19S) у эукариот состоит из 19 протеинов (совпадение коэффициента седиментации и количества протеинов тут — это просто случайное совпадение). Она состоит из двух четко различимых частей: одна состоит из 9 протеинов, и вторая из 10. Та, что состоит из 9 протеинов, соединена с α-кольцом, а та, что из 10 — торчит с края протеасомы, являясь своего рода «крышкой». Здесь важно отметить, что 6 из девяти протеинов, составляющих часть «шапки», примыкающую к α-кольцу, являются аденозинтрифосфатазами, и это очень важно. Аденозинтрифосфотаза ( ATPase [eɪtɪpɪ’eɪs] ) — это тот самый фермент, который способен отщеплять от молекулы аденозинтрифосфорной кислоты (АТФ — источник энергии в клетке) один или два остатка фосфорной кислоты с освобождением энергии, используемой в процессах мышечного сокращения, транспорта веществ через мембраны, биосинтеза различных соединений. А в данном случае эта энергия требуется протеасоме для того, чтобы открыть шапку и впустить туда расплетенный протеин. Таким образом эти шесть аденозинтрифосфатаз являются моторчиками, которые открывают и закрывают люк, ведущий в активный каталитический центр протеасомы. Этот механизм был тщательно изучен совсем недавно.
Часть 4: немного деталей о взаимодействии 19S и 20S в процессе организации деградации протеина.
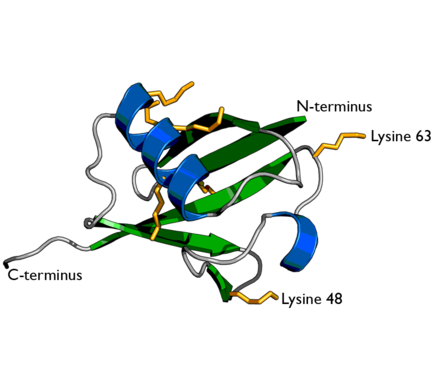
Сначала нужно ввести один термин — «С-конец» ( C-terminus [‘sɪ-‘tɜːmɪnəs] ). Или, более развернуто, «карбоксильный конец». Как известно, каждая аминокислота имеет в своем составе аминогруппу NH2, с которой она, условно говоря, начинается, а также карбоксильную группу COOH, которой она, условно говоря, заканчивается. Так вот эта аминокислота, расположенная на одном из концов молекулы протеина, обладающая свободной карбоксильной группой, и называется С-концом этого протеина. Для примера можно посмотреть на картинку:
Тут изображен тетрапептид (то есть пептид, состоящий из четырех аминокислот) Val-Gly-Ser-Ala, на котором зелёным цветом отмечена N-конечная α-аминокислота (L-валин), а синим — C-конечная α-аминокислота (L-аланин). Так что в данном полипептиде С-концом является L-аланин. Это просто.
Теперь, когда к 19S прицепился подлежащий деградации протеин, 19S должна не просто открыться, но и подать сигнал, активизирующий 20S. Такими сигналами и являются С-концы протеасомальных аденозинтрифосфатаз. Эти концы вставляются в специальные карманы в α-кольце 20S, в точности так же, как ключи вставляются в дверные замки, после чего «ворота» α-кольца приоткрывается и начинается процесс пропихивания уничтожаемого протеина внутрь 20S.
11S не содержат в себе аденозинтрифосфатаз, и поэтому у них нет возможности получить и использовать достаточное количество энергии для обработки длинных полипептидов, но с короткими они справляются другим путем.
Часть 5: сбои в работе протеасомной системы (UPS) + побольше об убиквитине.
Легко понять, что есть две основных разновидности неадекватной работы UPS. Во-первых, она может быть сверхактивна ( over zealous [‘əuvə ‘zeləs] ), в результате чего полезные и нужные клетке протеины начинают уничтожаться. Или, наоборот, UPS может быть заторможена тем или иным способом, так что потенциально вредные протеины остаются в клетке и создается их токсичная концентрация. Дисбаланс в работе UPS приводит к таким заболеваниям, как болезнь Альцгеймера, а также к ряду инфекционных заболеваний, а также к воспалительным заболеваниям, таким как ревматоидный артрит. В каждый момент времени в клетке существуют тысячи различных протеинов, так что UPS выполняет сложную и непростую работу по поддержанию порядка в этом зверинце.
Мы уже знаем, что в клетке в большом количестве присутствуют молекулы убиквитина, и конечно же они не могут и не должны самопроизвольно прицепляться к протеинам, иначе наступит хаос и клетка умрет. Пора получить немного ясности о том, как устроена молекула убиквитина, просто чтобы представить ее себе немного яснее.
Молекула убиквитина состоит из 76 аминокислот, то есть она является очень коротким протеином. Свое название она получила от английского слова «ubiquitous» [juː‘bɪkwɪtəs], что означает «вездесущий», «повсеместный» — это потому, что встречается убиквитин в самом деле везде и помногу, поскольку выполняет очень важные функции. Интересно, что структура убиквитина очень консервативна, и он практически идентичен что в клетках человека, что в клетках каких-нибудь дрожжей. Если мы возьмем ДНК и посмотрим на гены, кодирующие убиквитин, то увидим любопытную вещь — эти гены расположены один за другим по несколько штук, и понятно почему — ведь клетке нужно много убиквитина, так что удобнее, чтобы за один проход считывания генома они бы продуцировались сразу пачками. Считается, что убиквитин вообще является рекордсменом с точки зрения своей консервативности и неизменности в ходе эволюции — на настоящее время это самый медленно эволюционирующий протеин из всех, известных науке — настолько его конструкция удачна и удобна для выполнения своих функций, что улучшать ее не было необходимости. Убиквитин содержит семь лизиновых остатков, к каждому из которых могут подцепляться другие молекулы убиквитина, образуя убиквитиновую цепочку. И что это будет за цепочка, какие именно фукции она будет выполнять — это зависит от того, к каким именно лизиновым остаткам цепляются молекулы, ведь разнообразие функций, выполняемых убиквитином в клетке, отнюдь не исчерпывается его ролью в деградации ненужных протеинов. Если убиквитины будут цепляться за лизин-48 — вот тогда они и станут тем самым хвостом, которым снабжается предназначенный к уничтожению протеин.
Часть 6: немного о механизме присоединения убиквитина к протеину-мишени.
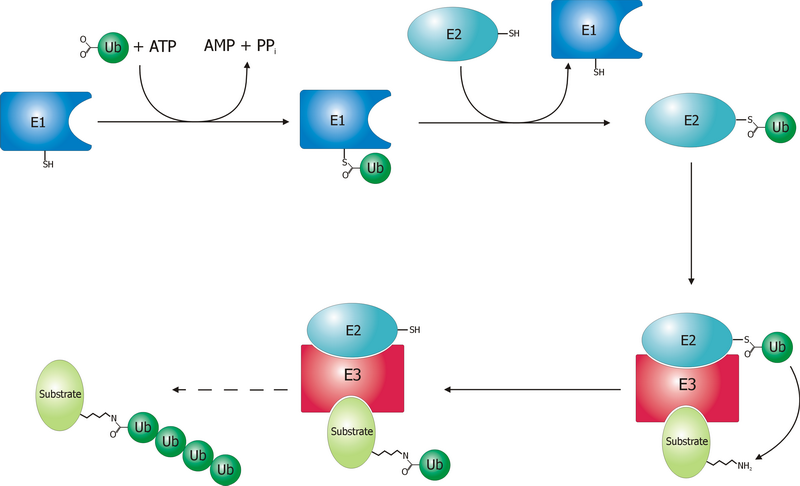
Детализированная схема этого процесса, конечно же, очень сложна, но можно для начала изложить ее буквально в нескольких фразах. Все начинается с того, что специальный фермент, называемый E1 (его более полное название «E1 ubiquitin activating enzyme») прицепляет к себе убиквитин, в результате чего пространственная структура убиквитина немного меняется и он становится «активированным». Для того, чтобы насильно присоединить к себе убиквитин, E1 использует энергию расщепления АТФ.
Активированный убиквитин теперь становится способен самостоятельно прикрепиться к другому ферменту, который называется Е2 (его более полное название «E2 ubiquitin conjugating enzume»), который тащит его не абы куда, а целенаправленно к ферменту, который называется Е3 (более полное его название — «E3 ligase enzyme»). А фермент Е3 особый — грубо говоря, у него две активные стороны. Одной стороной он цепляется к протеину, который надо уничтожить, а другая его сторона готова присоединить Е2, но не пустой, а именно нагруженный убиквитином. Туда Е2 и цепляется. Теперь Е3 с одной стороны имеет протеин-мишень, а с другой стороны — груженый убиквитином Е2. При этом электрические поля этих молекул так перераспределяются, что становится энергетически выгодно, чтобы в этой новообразованной большой молекуле убиквитин переместился на мишень-протеин, что он и делает, прицепляясь своей последней, 76-й аминокислотой (глицин 76) к лизину протеина-мишени. А это перемещение убиквитина в свою очередь снова видоизменяет конфигурацию полей, так что пустой Е2 больше не может цепляться за Е3 и отлипает, и на освободившееся место приходит новая Е2, груженая убиквитином, который тут же пристраивается к предудыщему — так и образуется убиквитиновый хвост на мишени-протеине. Как только такой хвост создан, судьба мишени становится предрешенной и ничто ее уже не спасет от транспортировки к протеасоме и последующей деградации.
В организме человека на сегодняшний день известно около тысячи разных Е3-лигаз, что отражает огромное разнообразие протеинов, которых время от времени нужно подвергать деградации. Разных видов Е2 у человека насчитывается 35 штук (что, кстати, является максимумом среди всех организмов). Можно себе вообразить — сколько существует их возможных сочетаний!